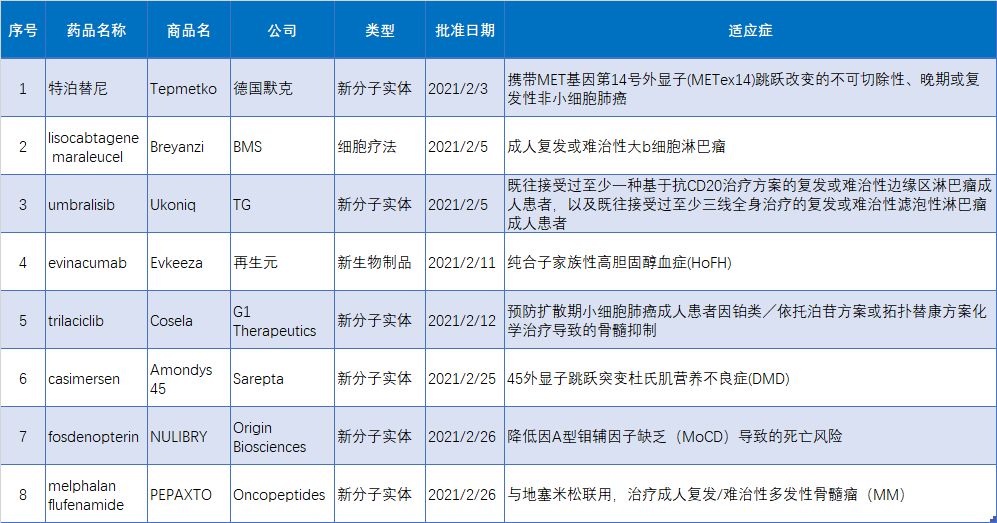
2021年2月 fda批准的8款新药
2020年2月fda共批准8款新药(不包括疫苗),包括6款新分子实体,1款单抗类生物制品,1款细胞疗法。2021年2月fda批准的新药1. Tepmetko(特泊替尼)2月3日,fda通过优先审评方式批准德国默克旗下公司EMD Serono开发的MET抑制剂tepotinib(商品名:TEPMETKO)上市,用于治疗携带MET基因第1
fda批准第三款新冠疫苗紧急使用授权
美国食品和药物管理局(fda)批准强生公司(Johnson&Johnson)生产的新冠疫苗可在美国紧急使用,适用于18岁及以上人群预防由新型冠状病毒感染引起的疾病(COVID-19)。这是继美国制药商辉瑞公司与德国公司BioNTech合作开发的第一种疫苗以及美国制药商Moderna公司开发的第二种疫苗之后,第三种在该国获得
康宁杰瑞PD-L1/CTLA-4双抗KN046美国Ⅱ期注册临床IND获fda批准
3月9日,康宁杰瑞生物制药宣布,PD-L1/CTLA-4双特异性抗体KN046的关键临床IND获得美国食品药品监督管理局(fda)批准,同意在美国开展一项开放、多中心的Ⅱ期注册临床研究(研究编号:KN046-205, ENREACH-Thymic),旨在评估KN046(PD-L1/CTLA-4双特异性抗体)治疗胸腺癌的有效
美国fda授予干细胞衍生的完全分化胰岛细胞疗法VX-880快速通道资格!
VX-880是一种干细胞衍生的、完全分化的胰岛细胞疗法,有潜力恢复胰岛细胞功能来恢复机体调节血糖水平的能力。
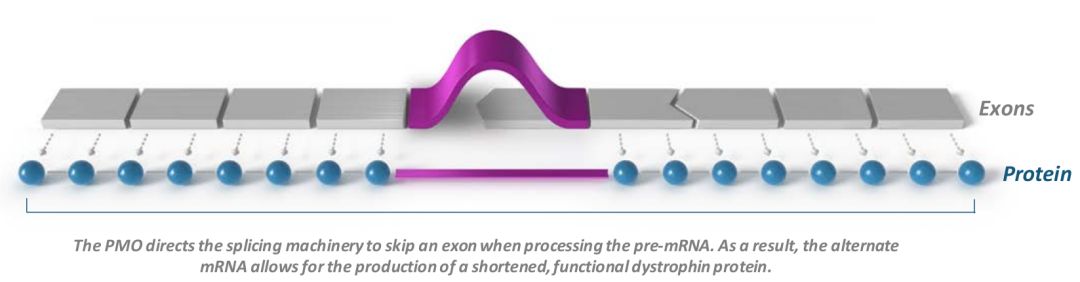
Sarepta公司第3款反义寡核苷酸疗法获fda批准上市
罕见病精准基因治疗领域领导者Sarepta公司宣布,fda已批准反义寡核苷酸药物AMONDYS 45 (casimersen)上市,用于45外显子跳跃突变杜氏肌营养不良症(DMD)患者治疗。这是Sarepta获批的第3款反义寡核苷疗法。此前,Sarepta的反义寡核苷疗法依特立生已于2016年9月获fda批准用于治疗经证实具有51外显
国产抗PD-1单抗向美国fda滚动提交上市申请,用于治疗鼻咽癌
2021年3月3日,君实生物(1877.HK,688180.SH)宣布,公司已于近日向美国食品药品监督管理局(fda)滚动提交了特瑞普利单抗用于治疗复发或转移性鼻咽癌(NPC)的生物制品许可申请(BLA)。特瑞普利单抗成为首个向美国fda提交上市申请的国产抗PD-1单抗。特瑞普利单抗注射液(拓益)由君实生物自主研发,是中国首个批准上市
辉瑞/BioNTech 疫苗获fda批准可在正常冷冻温度下保存2周
美国食品药物管理局(fda)宣布,批准辉瑞/BioNTech mRNA疫苗(商品名:Comirnaty )在常规药品冷冻箱温度下(-25℃至-15℃)运输和储存2周时间。以作为在超低温(-80℃至-60℃)冰箱中储存的替代或补充。Comirnaty 是基于BioNTech专有mRNA技术,由辉瑞和BioNTech 共同开发