肾细胞癌(RCC)靶向新药!AVEO口服下一代VEGF-TKI Fotivda获美国FDA批准!
来源:本站原创 2021-03-11 19:38
Fotivda是一种口服、下一代血管内皮生长因子受体(VEGFR)酪氨酸激酶抑制剂(TKI)。

2021年03月11日讯 /生物谷BIOON/ --AVEO Oncology近日宣布,美国食品和药物管理局(FDA)已批准靶向抗癌药Fotivda(tivozanib),该药是一种口服、下一代血管内皮生长因子受体(VEGFR)酪氨酸激酶抑制剂(TKI),用于治疗接受过2种或2种以上系统治疗方案的复发性或难治性肾细胞癌(RCC)成人患者。
复发性或难治性RCC是一种毁灭性疾病,由于耐受性和疗效之间的权衡,患者的预后可能受到限制。FDA批准Fotivda是一个令人兴奋的、有意义的进步,它为这类患者提供了一种新的治疗选择。
AEVO公司计划于2021年3月31日将Fotivda推向市场。用药方面,Fotivda的推荐剂量为1.34毫克,每天口服一次,可与或不与食物同服,每28天一个周期中,服药21天、停药7天,直到疾病进展或出现不可接受的毒性。
Fotivda的批准是基于关键III期临床研究TIVO-3的结果。该药申请也得到了另外三项研究的支持,包括III期研究TIVO-1(比较Fotivda与索拉非尼一线治疗RCC)、2项II期研究(Study 902,Study 201)。
TIVO-3是一项随机、阳性对照、多中心、开放标签研究,在351例高度难治性晚期或转移性RCC患者中开展,评估了Fotivda相对于拜耳靶向抗癌药Nexavar(多吉美,通用名:sorafenib,索拉非尼)的疗效和安全性。入组该研究的患者之前已接受至少2种方案治疗失败,大约26%的患者在早期治疗中已接受了免疫检查点抑制剂治疗。该研究的主要疗效指标是无进展生存期(PFS),其他疗效指标为总生存期(OS)和客观缓解率(ORR)。
值得一提的是,TIVO-3研究是在接受过2种或2种以上系统治疗方案的RCC患者中获得阳性结果的首个III期研究,也是纳入先前已接受过免疫疗法(目前早期治疗的标准护理方案)的一个预先定义患者群体的首个3期RCC研究。
结果显示:(1)与Nexavar治疗组相比,Fotivda治疗组中位无进展生存期(PFS)延长44%(5.6个月 vs 3.9个月)、疾病进展或死亡风险降低26%(HR=0.74,p=0.016)。在既往接受和没有接受免疫检查点抑制剂治疗患者中,Fotivda的PFS均较Nexavar延长。(2)Fotivda治疗组的中位OS为16.4个月、Nexavar治疗组为19.2个月(HR=0.97,95%CI:0.75-1.24)。(3)Fotivda治疗组ORR为18%,Nexavar治疗组为8%(p=0.02)。
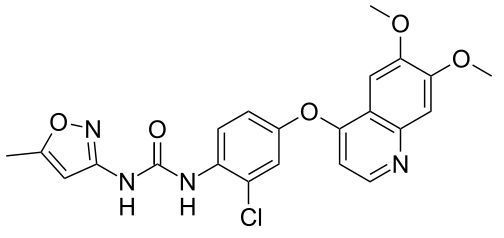
tivozanib分子结构式(图片来源:Wikipedia)
TIVO-3研究的首席研究员、克利夫兰诊所泌尿生殖肿瘤项目主任Brian Rini教授此前表示:“在治疗RCC的VEGF TKI类药物中,tivozanib的治疗特点是非常独特的。来自TIVO-3研究的数据显示该药具有显著的PFS获益和良好的耐受性。在晚期RCC群体中,这些结果特别有意义,该研究提供了首个大型、关键数据显示了早期TKI和免疫疗法之后的治疗顺序,突显了tivozanib在不断演化的RCC治疗模式中的重要地位。”
tivozanib是一种口服、每日一次的血管内皮生长因子(VEGF)酪氨酸激酶抑制剂(TKI),由日本药企协和麒麟(Kyowa Kirin)发现,该药已获欧盟、挪威、新西兰、冰岛批准用于晚期RCC成人患者。tivozanib是一种强效、选择性、长效抑制剂,可抑制所有3种VEFG受体,同时具有最小化的脱靶毒性,潜在地带来改善的疗效和最小化的剂量调整。在临床前模型中,当与免疫调节疗法联合用药时,tivozanib能够显著减少调节性T细胞产生、潜在地增强活性。
在RCC II期研究中,tivozanib与百时美施贵宝抗PD-1疗法Opdivo(欧狄沃,nivolumab,纳武利尤单抗)联合用药显示出协同作用。目前,tivozanib正被调查用于多种类型肿瘤的治疗,包括肾细胞癌、肝细胞癌、结直肠癌、卵巢癌和乳腺癌。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


