解决CAR-T的“阿喀琉斯之踵”!抗GM-CSF单抗lenzilumab联合Yescarta治疗淋巴瘤(DLBCL):有效率100%,无严重CRS/NT事件!
来源:本站原创 2021-04-20 10:07
细胞因子释放综合征(CRS)和神经毒性(NT)是CAR-T细胞治疗的“阿喀琉斯之踵”。lenzilumab能够结合并中和GM-CSF的活性,可用于预防和治疗细胞因子释放综合征(CRS)。

2021年04月20日讯 /生物谷BIOON/ --Humanigen是一家临床阶段的生物制药公司,专注于通过其先导候选药物抗人GM-CSF单克隆抗体lenzilumab预防和治疗称为“细胞因子风暴(Cytokine Storm)”的过度免疫反应。近日,该公司公布了ZUMA-19研究1b期部分的阳性数据,该研究正在评估lenzilumab联合CAR-T细胞疗法治疗弥漫性大B细胞淋巴瘤(DLBCL)患者的疗效和安全性。
结果显示,在推荐的lenzilumab 2期剂量下,客观缓解率(ORR)达到了100%,没有患者出现严重的细胞因子释放综合征(CRS)或严重的神经毒性(NT)。
ZUMA-19是一项临床研究,正在评估lenzilumab与吉利德CD19 CAR-T细胞疗法Yescarta(axicabtagene ciloleucel,Axi-Cel)治疗复发或难治性DLBCL的疗效和安全性。该研究采用标准的3+3设计,3例患者在CAR-T前接受600mg剂量lenzilumab(队列1)、3例患者在CAR-T前接受1800mg剂量lenzilumab(队列2)。推荐的2期剂量被确定为1800mg。
在6例研究患者中,ORR为83%(n=5),其中包括4例完全缓解(CR)。在队列1中,没有发生严重的CRS(≥3级)。一例患者经历了为期2天的3级NT。在推荐的lenzilumab 2期剂量(队列2),ORR为100%(n=3),无毒性CR(CRS和NT<2级)为66%(n=2)。在推荐的2期剂量下,没有出现严重的CRS或严重的NT。在整个研究中,没有不良事件被归因于lenzilumab。炎症标志物与CRS和NT的降低率相关。lenzilumab呈剂量依赖性降低了髓系细胞因子IL-6、IL-8、MCP-1和IP-10(CXCL-10)以及全身炎症标记物CRP、铁蛋白和SAA。
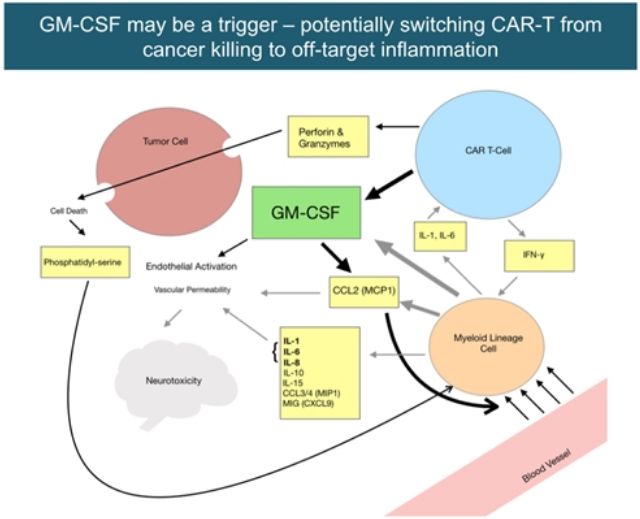
GM-CSF作为CAR-T相关毒性启动因子的科学基础
Humanigen首席科学官Dale Chappell医学博士表示:“ZUMA-19研究的这些令人鼓舞的结果,进一步证明了lenzilumab可能打破与CAR-T广泛相关的疗效和毒性(CRS和NT)之间的联系,并可能提高缓解的持久性。我们相信这些数据证明了开展一项涉及多种CAR-T细胞疗法的更大规模研究的必要性。”
Humanigen将启动一项随机、多中心、潜在注册2期研究,以评估lenzilumab联合所有市售CD19 CAR-T细胞疗法治疗DLBCL患者的疗效和安全性。这项研究计划入组约150名患者,研究方案正在提交给FDA。
Humanigen已终止与吉利德旗下细胞治疗公司Kite签订的与ZUMA-19相关的临床合作协议,双方将合作结束当前的研究活动。
Humanigen首席执行官Cameron Durrant表示:“Humanigen很高兴能够在整个CAR-T领域积极开发lenzilumab,并进一步扩大其产品线。我们感谢Kite的赞助和贡献,使Humanigen能够发展到目前这一激动人心的地步。”
lenzilumab是一种抗人粒细胞巨噬细胞集落刺激因子(GM-CSF)中和抗体,GM-CSF是一种在组织急性及慢性炎症中起关键作用的细胞因子。lenzilumab能够靶向结合并中和GM-CSF的活性,抑制由GM-CSF启动的炎症级联反应,从而预防和治疗与CAR-T治疗过程中与GM-CSF相关的细胞因子风暴和神经毒性。
2017年8月,罗氏抗炎药IL-6R抗体Actemra(雅美罗,通用名:tocilizumab,托珠单抗)获得美国FDA批准,用于2岁及以上患者治疗CAR-T细胞疗法诱导的严重或危及生命的CRS。此次批准,使Actemra成为了首个治疗CRS的疗法。
CAR-T疗法-黑框警告
Yescarta是一款CD19 CAR-T细胞疗法,由吉利德豪掷119亿美元收购Kite获得。在美国,Yescarta于2017年10月获FDA批准,是第一个治疗复发或难治性大B细胞淋巴瘤(LBLC)成人患者的CAR-T细胞疗法,具体适应症为:用于既往接受过2种或多种系统疗法的复发或难治性LBCL成人患者的治疗,包括弥漫性大B细胞淋巴瘤(DLBCL)、原发性纵膈大B细胞淋巴瘤(PMBCL)、高级别B细胞淋巴瘤(HGBL),以及源于滤泡性淋巴瘤(FL)的DLBCL(即转化型FL,TFL)。Yescarta不适用于原发性中枢神经系统淋巴瘤的治疗。
2021年3月,Yescarta获美国FDA批准一个新的适应症:用于治疗先前已接受过2种或多种系统疗法的复发性或难治性(R/R)滤泡性淋巴瘤(FL)成人患者。
值得注意的是,目前已上市的CAR-T细胞疗法(包括Yescarta),其美国处方信息中均附有关于CRS和NT的黑框警告。(生物谷Bioon.com)
原文出处:Humanigen Reports Positive Data With Lenzilumab in the ZUMA-19 CAR-T Phase 1b Study in DLBCL and Plans to Initiate a Potential Registrational Study
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->



