急性髓性白血病(AML)一线新药!辉瑞Hedgehog通路抑制剂Daurismo获欧盟批准!
来源:本站原创 2020-07-01 21:28
Daurismo通过结合并抑制Smoothened(SMO)蛋白,来抑制Hedgehog信号通路。

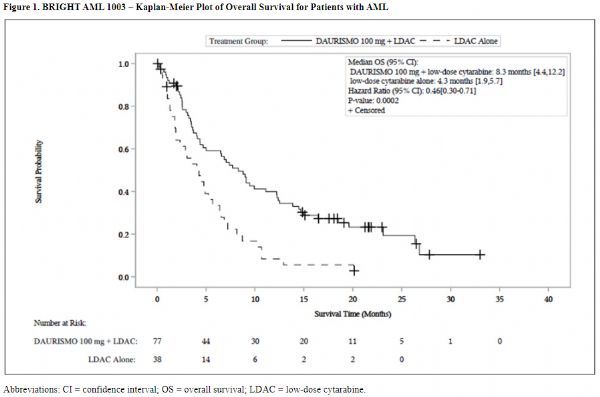
2020年07月01日讯 /生物谷BIOON/ --辉瑞(Pfizer)近日宣布,欧盟委员会(EC)已批准靶向抗癌药Daurismo(glasdegib),联合低剂量阿糖胞苷(LDAC)化疗,用于治疗新诊断的(新发或继发)、不适合标准化疗的急性髓性白血病(AML)成人患者。此次批准基于II期BRIGHT 1003试验的结果,数据显示,与LDAC相比,Daurismo+LDAC将总生存期(OS)延长近一倍(8.3个月 vs 4.7个月)、将死亡风险显著降低54%。
Daurismo是一种每日口服一次的Hedgehog信号通路抑制剂,已于2018年11月获得美国FDA批准。该药是第一个被批准用于治疗AML的Hedgehog信号通路抑制剂,适用于联合LDAC,一线治疗新诊断的2类AML成人患者:(1)年龄≥75岁的老年AML患者;(2)因同时存在其他疾病而不适合进行强化诱导化疗的AML成人患者。
需要注意的是,Daurismo的药物标签中有一个黑框警告,提示:(1)Daurismo可能导致胚胎-胎儿死亡或严重的出生缺陷,该药在动物研究中显示出胚胎毒性、胎儿毒性、致畸性。(2)在启动Daurismo治疗前,应对有生殖潜力的女性进行妊娠测试,建议女性患者在服用Daurismo治疗期间和最后一次给药后至少30天内使用有效的避孕措施。(3)女性有通过男性精液暴露Daurismo的潜在风险,男性患者在服用Daurismo期间和最后一次给药至少30天内,与妊娠女性或有生殖潜力的女性进行性活动时,应使用避孕套,以避免女性发生潜在的药物暴露。
Daurismo通过结合并抑制Smoothened(SMO)蛋白,来抑制Hedgehog信号通路。SMO蛋白是一种跨膜蛋白,参与Hedgehog信号通路,该信号通路在胚胎发生过程中起着至关重要的作用。然而,在成人中,Hedgehog信号通路的异常激活被认为有助于癌症干细胞发育和存活,在多种类型癌症的发生和发展中发挥作用,包括实体瘤和血液系统恶性肿瘤。在异种移植人类AML的小鼠模型中,Daurismo联合低剂量阿糖胞苷(LDAC),与单用Daurismo或LDAC相比,抑制肿瘤体积增加的效应更强,同时还降低了骨髓中CD45+/CD33+母细胞的百分比。
目前,辉瑞正在进一步推进Daurismo的临床开发,用于治疗多种疾病。根据clinicaltrials.gov检索数据,该药正在进行的临床试验包括:治疗新诊断的胶质母细胞瘤、治疗慢性移植物抗宿主病、联合2种标准地西他滨方案治疗高危老年AML患者、复发或难治性AML等。

Daurismo(glasdegib+马来酸;图片来源:Daurismo处方标签)
辉瑞国际肿瘤开发市场区域总裁Masum Hossain表示:“急性髓系白血病患者的护理标准是强化化疗,但是,对于许多老年患者以及那些在确诊前存在某些健康状况的患者来说,这不是一个选择。通过欧盟委员会对Daurismo的批准,我们很自豪能够进一步履行我们对血癌患者长达数十年的承诺,为欧洲治疗选择有限的某些急性髓系白血病患者提供这种新的治疗方案。”
西班牙瓦伦西亚拉菲大学医院主治医师Pau Montesinos医学博士表示。“BRIGHT 1003试验表明,与单用低剂量阿糖胞苷相比,Daurismo联合低剂量阿糖胞苷几乎使总生存期增加了一倍。先前接受过治疗、经不起强化化疗的急性髓性白血病患者,迫切需要新的治疗选择。我期待着使用这种新疗法,来延长合适的AML患者的生存期。”
BRIGHT 1003是一项关键性、随机、开放标签、多中心、国际性II期临床研究,共入组了116例先前没有接受过治疗、不符合强化化疗资格的新发或继发性AML成人。研究中,这些患者以2:1的比例随机分配至2个治疗组,一组接受Daurismo+LDAC,另一组接受LDAC。在接受Daurismo+LDAC治疗的78例患者中,超过一半(51%,40例)为继发性AML,或由于先前的血液/骨髓疾病、或先前的抗癌治疗而发展成AML,这40例患者中有11例曾接受过低甲基化药物治疗,从历史数据来看,这类患者的预后很差,治疗选择仅限于参加临床试验或姑息治疗。
研究结果显示:在没有资格接受强化化疗的AML患者中,与LDAC相比,Daurismo+LDAC治疗将总生存期(OS)几乎增加了一倍(中位OS:8.3个月 vs 4.3个月,HR=0.463,95%CI:0.299-0.717)。这一差异表明,与LDAC组患者相比,Daurismo+LDAC组患者的死亡风险降低了54%(单侧p值=0.0002)。
研究中,在接受Daurismo治疗的患者中,最常见的不良反应(发生率≥20%)包括贫血(45.2%)、出血(45.2%)、中性粒细胞减少(35.7%)、恶心(35.7%)、食欲下降(33.3%)、疲劳(30.9%)、肌肉痉挛(30.9%)、血小板减少(30.9%)、发热(29.7%)、腹泻(28.5%)、肺炎(28.5%)、嗅觉障碍(26.1%)、周围水肿(26.1%)、便秘(25.0%)、腹痛(25.0%)、皮疹(25.0%)、呼吸困难(25.0%)、呕吐(21.4%)、体重减轻(20.2%)。在接受Daurismo治疗的患者中,导致剂量减少的最常见不良反应包括:肌肉痉挛(4.7%)、疲劳(3.5%)、中性粒细胞减少(3.5%)、贫血(2.3%)、血小板减少(2.3%)、心电图QT延长(2.3%)。在接受Daurismo治疗的患者中,导致永久停药的最常见不良反应包括:肺炎(5.9%)、中性粒细胞减少症(3.5%)、恶心(2.3%)。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->