肿瘤诱导性骨软化症(TIO)新药!全球FGF-23靶向单抗Crysvita新适应症获美国FDA优先审查!
来源:本站原创 2020-02-28 12:00
2020年02月28日讯 /生物谷BIOON/ --Ultragenyx制药公司与合作伙伴协和麒麟(Kyowa Kirin)近日联合宣布,美国食品和药物管理局(FDA)已受理Crysvita(burosumab)的补充生物制品许可申请(sBLA)并授予了优先审查。该sBLA寻求批准Crysvita一个新的适应症,用于治疗与不能根治性切除或定位的磷酸盐尿性间叶

2020年02月28日讯 /生物谷BIOON/ --Ultragenyx制药公司与合作伙伴协和麒麟(Kyowa Kirin)近日联合宣布,美国食品和药物管理局(FDA)已受理Crysvita(burosumab)的补充生物制品许可申请(sBLA)并授予了优先审查。该sBLA寻求批准Crysvita一个新的适应症,用于治疗与不能根治性切除或定位的磷酸盐尿性间叶瘤(肿瘤诱导性骨软化症,TIO)有关的FGF23相关低磷血症。FDA已指定处方药用户收费法(PDUFA)目标日期为2020年6月18日。
Crysvita是第一种直接靶向成纤维细胞生长因子23(FGF-23)的重组全人单克隆IgG1抗体,之前已被批准成为第一个治疗X-连锁低磷血症(XLH)的药物。此次sBLA如果获批,Crysvita将成为第一个治疗不能根治性切除或定位的TIO有关的FGF23相关低磷血症患者的药物。
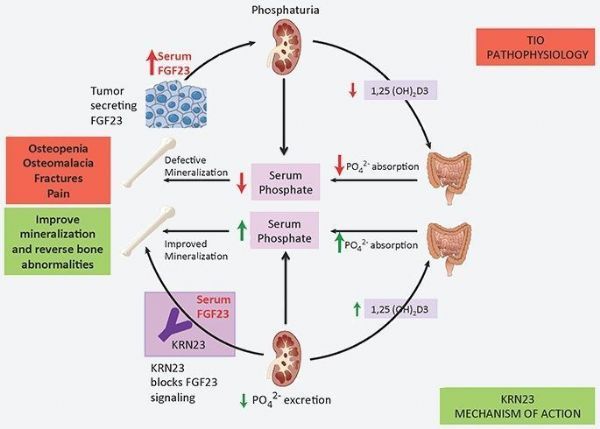
TIO是由典型的良性肿瘤引起的,这些肿瘤产生过多的成纤维细胞生长因子23(FGF-23),导致尿液中的磷酸盐消耗,导致严重的低磷血症、骨软化、肌肉无力、疲劳、骨痛和骨折。如果病因肿瘤或病变可以切除,症状会很快消失;但也有不可行切除或肿瘤切除后复发的情况。对于肿瘤或病变不能手术的患者,目前的治疗方法包括口服磷酸盐和/或维生素D替代物。这种治疗方法的疗效往往是有限的,因为它不能治疗疾病的病因,且其益处必须与监测潜在的风险(如肾钙质沉着症、高钙尿症和甲状旁腺功能亢进症)相平衡。据估计,美国有500-1000人患有TIO,约有一半的病例不能手术。
Ultragenyx首席医疗官Camille L. Bedrosian医学博士表示:“大约有一半的TIO患者存在无法手术切除的肿瘤,这些患者没有其他的治疗方法。我们感谢FDA在评估数据方面的合作,这使我们距离为这种毁灭性疾病患者带来第一种疗法又近了一步。我们期待在审查过程中继续与FDA密切合作,以期将Crysvita带给TIO患者。”
sBLA数据包包括2项单臂II期研究的数据,其中一项是Ultragenyx在美国开展的、涉及14例成人患者的144周研究,另一项是协和麒麟在日本和韩国开展的、涉及13例成人患者的88周研究。在这两项研究中,Crysvita与血清磷和血清1,25-二羟维生素D水平的升高有相关。磷酸盐水平的增加导致骨软化症、活动性和活力的改善。骨扫描也显示在Crysvita治疗期间愈合的骨折增加、新骨折减少。在研究期间,不良事件通常反映患者的内在疾病,没有严重的治疗相关不良事件。
Crysvita(burosumab)作用机制(图片来源:Ultragenyx网站)
Crysvita是一种重组全人单克隆IgG1抗体,由协和发酵麒麟发现,是第一种直接靶向成纤维细胞生长因子23(FGF-23)的药物。FGF23是一种“磷酸盐尿性”激素,通过调节磷酸盐排泄和肾脏内活性生物素D的生成来降低血清里的磷酸盐和活性维生素D水平。目前,Crysvita已被开发用于治疗与FGF-23相关的低血磷疾病,例如X连锁低磷血症(XLH)和肿瘤诱导的骨软化症(TIO)/表皮痣综合征(ENS)。
FGF-23相关的低磷性佝偻病和骨软化症中的磷酸盐消耗是由FGF-23水平和活性过高所引起的。Crysvita可靶向结合并抑制FGF-23的生物活性活性。通过阻断患者体内过多的FGF-23,Crysvita可增加肾脏对磷酸盐的再吸收、增加活性维生素D的产生,从而也增强肠道对磷酸盐和钙的吸收。因此,低磷血症和骨矿化缺陷可以得到改善。
Crysvita由协和发酵麒麟与Ultragenyx合作开发。监管方面,在美国,Crysvita获FDA批准,用于治疗≥6个月儿童和成人的X-连锁低磷血症(XLH);在加拿大和巴西,Crysvita被批准用于治疗≥1岁儿童和成人的XLH;在日本,Crysvita被批准治疗FGF23相关的低磷性佝偻病和骨软化症;在欧盟,Crysvita被有条件批准用于治疗≥1岁、存在骨骼疾病放射学证据、骨骼生长的儿童和青少年的XLH,扩大应用于成人XLH的申请正在接受EMA的审查。
之前,Crysvita在美国和欧盟均被授予了治疗XLH的孤儿药资格,并在美国获得了突破性药物资格。XLH是儿童遗传性佝偻病最常见的病因,其早期识别对于适当的儿科管理和监测与疾病相关的并发症以及治疗至关重要。
Crysvita于2018年1月获批上市,是全球首个治疗XLH的药物。2019年10月,美国FDA批准Crysvita(burosumab)标签扩展,纳入了新的临床数据,显示Crysvita治疗XLH儿科患者疗效优于口服磷酸盐和活性维生素D(常规治疗),以及Crysvita在长期治疗的成人患者中改善僵硬及维持疗效。此外,Crysvita的适应症也扩大至包括年龄低至6个月大的婴儿。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->