造血干细胞研究进展(第5期)
- Cas9
- CRISPR
- HSC-iNKT
- IFITM
- β-地中海贫血
- 临床试验
- 伟哥
- 卡巴酚A
- 基因疗法
- 基因编辑
- 复发缓解型多发性硬化症
- 托珠单抗
- 毒蕈碱乙酰胆碱受体
- 溶酶体
- 白细胞
- 红细胞
- 结核杆菌
- 视神经脊髓炎
- 造血干细胞
- 镰状细胞病
- 骨髓移植
来源:本站原创 2019-10-27 13:38
2019年10月27日讯/生物谷BIOON/---造血干细胞(hemapoietic stem cell, HSC)是存在于造血组织中的一群原始造血细胞,它不是组织固定细胞,可存在于造血组织及血液中。造血干细胞在人胚胎2周时可出现于卵黄囊,妊娠5个月后,骨髓开始造血,出生后骨髓成为干细胞的主要来源。在造血组织中,所占比例甚少。现代医学中,造血干细胞在骨髓移植和疾病治疗方面有重要作用。1988年法国
2019年10月27日讯/生物谷BIOON/---造血干细胞(hemapoietic stem cell, HSC)是存在于造血组织中的一群原始造血细胞,它不是组织固定细胞,可存在于造血组织及血液中。造血干细胞在人胚胎2周时可出现于卵黄囊,妊娠5个月后,骨髓开始造血,出生后骨髓成为干细胞的主要来源。在造血组织中,所占比例甚少。现代医学中,造血干细胞在骨髓移植和疾病治疗方面有重要作用。
1988年法国的Gluckman教授在国际上率先成功采用脐血造血干细胞移植,救治了一名贫血患儿,标志着脐带血造血干细胞移植时代的开启。全球现每年约进行6万例骨髓移植术,其中使用自体和同种异体造血干细胞完成骨髓移植术的患者人数分别为近3.5万和2.5万例。
造血干细胞的来源主要包括骨髓、外周血和脐带血。如今,“骨髓移植”已渐渐被“外周血造血干细胞移植”代替。也就是说,现在捐赠骨髓已不再抽取骨髓,而只是“献血”了。 脐带血是胎儿娩出断脐后残留在脐带和胎盘中的血液,富含造血干细胞,可用于治疗急、慢性白血病和某些恶性肿瘤等多种重大疾病。
基于此,小编针对近年来造血干细胞研究取得的进展进行一番梳理,以飨读者。
1.eLife:神奇!一种抗关节炎药物竟可阻止结核杆菌在造血干细胞中增殖
doi:10.7554/eLife.47013
在一项新的研究中,来自比利时天主教鲁汶大学和巴西桑塔卡塔琳娜联邦大学的研究人员发现一种用于抵抗关节炎的药物也可以阻止一种允许结核杆菌感染并劫持造血干细胞的过程。相关研究结果于2019年10月22日发表在eLife期刊上,论文标题为“An evolutionary recent IFN-IL-6-CEBP axis is linked to monocyte expansion and tuberculosis severity in humans”。论文通讯作者为天主教鲁汶大学免疫学家Johan Van Weyenbergh和桑塔卡塔琳娜联邦大学免疫学家André Báfica。
这些研究人员使用了来自健康捐献者骨髓和脐带血的造血干细胞。Van Weyenbergh说,“我们将这些造血干细胞放入试管中,并使其暴露于结核杆菌中。结果发生了两个过程:这种细菌感染了这些造血干细胞并开始在其中增殖。与此同时,这些造血干细胞将自身转化为 一类非常特殊的白细胞。在正常情况下,白细胞保护我们的身体免受感染,但是在这种情形下,它们被这种细菌劫持并成为它的理想宿主细胞。
好消息是,有一种方法可以阻止这个过程。Van Weyenbergh说:“我们对数据库进行了大规模的计算机分析,这些数据库具有对结核杆菌和造血干细胞都重要的基因。令我们吃惊的是,这种分析使得我们找到了一种抗关节炎的药物:托珠单抗(Tocilizumab)。在试管中 加入这种药物可以起到一箭双雕的作用:造血干细胞向宿主细胞的转化停止了,而且结核杆菌的增殖速率减慢了。”
2.JAMA:临床试验表明非清髓性自体造血干细胞移植有望治疗复发缓解型多发性硬化症
doi:10.1001/jama.2018.18743
非清髓性自体造血干细胞移植(nonmyeloablative autologous hematopoietic stem cell transplantation, 非清髓性自体HSCT)代表着一种减缓或预防的复发缓解型多发性硬化症(relapsing-remitting multiple sclerosis)的潜在有效方法,但是人们并不清楚它是 否优于疾病改善治疗(disease-modifying therapy, DMT)。
在一项新的临床研究中,为了比较非清髓性自体HSCT与DMT对疾病进展的影响,来自美国、瑞典、英国和巴西的研究人员开展了一项随机临床试验(临床试验登记号:NCT00273364)。结果发现,与DMT治疗相比,非清髓性自体HSCT治疗显著延长了病情进展时间。相关研究 结果近期发表在JAMA期刊上,论文标题为“Effect of Nonmyeloablative Hematopoietic Stem Cell Transplantation vs Continued Disease-Modifying Therapy on Disease Progression in Patients With Relapsing-Remitting Multiple Sclerosis”。
这些作者在2005年9月20日至2016年7月7日之间,在美国、欧洲和南美的4个中心共招募了110名复发缓解型多发性硬化症患者:在前一年接受DMT治疗后至少出现2次疾病复发;扩展残疾状态量表(Expanded Disability Status Scale, EDSS,评分范围为0到10,10为最严 重的神经神经残疾)的评分为2.0~6.0。这些作者对这些患者进行了随机分配。最后一次随访发生在2018年1月,数据库锁定发生在2018年2月。
在这110名随机分配的患者(73名[66%]妇女;平均年龄为36 [SD,8.6]岁)中,103人仍继续参加这项临床试验,其中98人在1年中接受评估,23人在5年中每年接受评估(中位随访2年;平均2.8年)。HSCT治疗组中的3名患者和DMT治疗组的34名患者发生了疾病进展。由 于发生的事件太少,HSCT治疗组无法计算中位进展时间。DMT治疗组的中位进展时间为24个月(四分位间距为18~48个月)(风险比为0.07; 95%CI为0.02-0.24;P <0.001)。在第一年,HSCT治疗组的EDSS平均评分从3.38降低到2.36,而DMT治疗组的平均EDSS评分从 3.31升高到3.98(组间平均差异为-1.7;95%CI为-2.03~-1.29; P <0.001)。没有患者死亡,而且接受HSCT治疗的患者没有出现非造血4级毒性事件(比如心肌梗塞,败血症或其他致残或潜在的危及生命的事件)。
3.Neurology:临床试验表明造血干细胞移植可逆转视神经脊髓炎
doi:10.1212/WNL.0000000000008394
在一项新的临床研究中,来自美国西北大学费恩柏格医学院和梅奥诊所的研究人员报道造血干细胞移植可逆转一种使人衰弱的神经系统疾病,这种称为视神经脊髓炎(neuromyelitis optica)的疾病导致一半的患者在确诊后5年内失明和失去行走的能力。大多数患者在接 受造血干细胞移植5年后保持良好,并且能够避免每年花费高达50万美元的药物治疗。相关研究结果近期发表在Neurology期刊上,论文标题为“Autologous nonmyeloablative hematopoietic stem cell transplantation for neuromyelitis optica”。
在这项临床研究中,12名视神经脊髓炎患者接受了造血干细胞移植。在移植5年后,在这12名患者中,仅有2人发生疾病复发,不得不重新接受药物治疗。这似乎是造血干细胞移植可以逆转的第四种慢性疾病。
论文第一作者、西北大学费恩柏格医学院医学教授、免疫疗法与自身免疫疾病负责人Richard Burt博士说,“造血干细胞移植和药物治疗之间存在明显的区别。造血干细胞移植改善了患者的神经功能障碍和生活质量。他们的病情好转,而且疾病标志物AQP4在移植后长达 五年的时间里消失了。”
4.Blood:植物成分能够提高基因疗法的速度与有效性
doi:10.1182/blood.2019000040
目前,基因疗法的治疗过程需要从患者血液中分离出非常少量的造血干细胞。这些细胞可以自我更新并产生所有其他类型的血细胞。然后,治疗基因通过专门设计的病毒(称为“慢病毒载体”)导入到这些细胞中。
然而,造血干细胞对病毒攻击具有高度的抵抗力。它们借助于干扰素诱导的跨膜蛋白IFITM来保护自己,该蛋白会拦截慢病毒载体。因此,Torbett说,要成功地将基因传递到造血干细胞中,可能需要许多尝试-以及大量昂贵的基因治疗载体。
美国斯克里普斯研究所免疫学和微生物学系副教授Torbett博士他的团队发现,将白藜芦醇样化合物卡巴酚A与慢病毒载体混合物一起添加到人类造血干细胞中,这些细胞会丧失其天然防御能力,并使慢病毒载体更容易进入。一旦将经过处理的干细胞移植到小鼠体内,它 们就会分裂并产生包含新遗传信息的血细胞。
该方法的另一个主要优点是时间短:如果可以在更短的时间内完成血液干细胞的基因递送治疗,则可以更快地将细胞重新施用给患者。Torbett说,这不仅使患者的治疗更加方便,而且还有助于确保干细胞不会失去自我更新的特性。
5.Cell子刊:有趣!伟哥有望用于造血干细胞移植
doi:10.1016/j.stemcr.2019.09.004
在一项新的研究中,来自美国加州大学圣克鲁兹分校的研究人员开发出一种快速地获得用于骨髓移植的供体造血干细胞的新方法,这种方法联合使用万艾可(Viagra,俗称伟哥)和另一种称为普乐沙福(Plerixafor)的药物。相关研究结果于2019年10月10日在线发表在 Stem Cell Reports期刊上,论文标题为“Viagra Enables Efficient, Single-Day Hematopoietic Stem Cell Mobilization”。
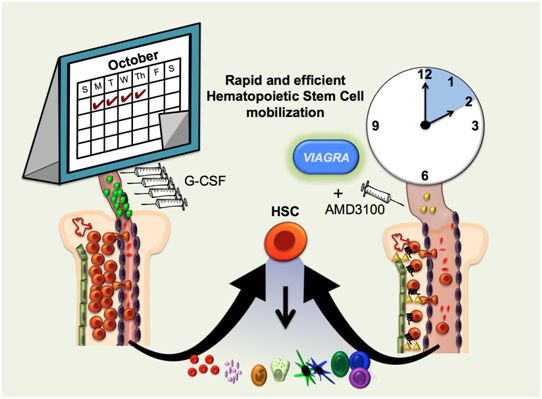
骨髓移植主要用于治疗癌症,是一种挽救生命的治疗方案,它可在患者的一生当中恢复产生新血细胞的造血干细胞。这些造血干细胞通常仅存在于骨髓中。为了获得用于骨髓移植的造血干细胞,人们最初需要在髋骨上钻孔并使用一种特殊的针从骨髓中直接取出造血干细 胞。如今,更常见的是使用药物让造血干细胞从骨髓进入血液中,然后从血液中收集它们。
用于将造血干细胞从骨髓动员到血液中的标准药物方案需要连续数天注射粒细胞集落刺激因子(GCSF),然后收集造血干细胞,这种收集通常是在注射GCSF 4至6天后进行的。尽管这种方法的侵入性不如直接从骨髓中提取造血干细胞,但是它并不总是成功的,而且经常会 引起骨痛和其他副作用,这会让许多可能会从骨髓移植中受益的患者无法耐受。
这项新研究展示了另一种替代方案,该方案可在2小时内动员骨髓中的造血干细胞。它涉及在口服单剂伟哥,两小时后注射一剂普乐沙福。论文通讯作者、加州大学圣克鲁兹分校生物分子工程教授Camilla Forsberg说,“我们的方法可能极大地增加受益于骨髓移植的患者 数量。尽管已有方法做到这一点,但是标准药物方案并不适合所有人。”
6.Science子刊:毒蕈碱乙酰胆碱受体调节早期红细胞祖细胞的自我更新
doi:10.1126/scitranslmed.aaw3781
成体干细胞和祖细胞具有独特的自我更新能力,靶向这一过程代表着潜在的治疗机会。早期的红细胞祖细胞,即爆发形成单位红细胞(burst-forming unit erythroid,BFU-E),具有巨大的自我更新潜力,是治疗贫血的关键细胞类型。然而,研究人员们目前对BFU-E自我 更新机制的了解非常有限。
在一项近日发表在《Science Translational Medicine》上的最新研究中,来自冷泉港实验室和Memorial Sloan Kettering癌症中心(MSKCC)等单位的研究人员合作,发现毒蕈碱乙酰胆碱受体、胆碱能受体、毒蕈碱4 (CHRM4)通路调节BFU-E的自我更新,而对CHRM4的药理 学抑制纠正了骨髓增生异常综合征(myelodysplastic syndrome,MDS)的贫血、衰老和溶血。
研究人员发现使用遗传学手段下调CHRM4或者选择性拮抗剂PD102807抑制CHRM4可促进BFU-E自我更新,而在体内应激条件下,删除CHRM4可增加红细胞生成。此外,研究人员还发现毒蕈碱乙酰胆碱受体拮抗剂纠正了小鼠体内MDS、衰老和溶血模型的贫血,延长了MDS小鼠的 生存期。
通过机制研究,研究人员发现毒蕈碱受体拮抗剂促进BFU-Es扩增的作用是通过循环AMP诱导转录因子CREB介导的,其作用靶点是上调BFU-E自我更新的关键调节因子。
7.Cell Stem Cell:经过基因改造的HSC-iNKT细胞提供持久的抗肿瘤免疫反应
doi:10.1016/j.stem.2019.08.004
恒定自然杀伤细胞(invariant natural killer T cell, iNKT)称为免疫系统的“特种部队”。尽管它们在体内相对较少,但是它们要比许多其他的免疫细胞功能强大。在一项针对小鼠的研究中,来自美国加州大学洛杉矶分校的研究人员发现他们可以利用iNKT细胞的功 能攻击肿瘤细胞并治疗癌症。这种方法可以抑制移植到小鼠体内的多种类型人类肿瘤的生长。相关研究结果发表在2019年10月3日的Cell Stem Cell期刊上,论文标题为“Development of Hematopoietic Stem Cell-Engineered Invariant Natural Killer T Cell Therapy for Cancer”。论文通讯作者为加州大学洛杉矶分校伊莱-艾迪斯布罗德再生医学与干细胞研究中心成员Lili Yang。论文第一作者为加州大学洛杉矶分校的Yanni Zhu和Drake Smith。
这些研究人员的目标是开发一种能永久性地增强人体自然产生更多iNKT细胞能力的疗法。他们从造血干细胞开始,其中造血干细胞是在骨髓中发现的细胞,它们可以自我复制,并可以变成所有类型的血细胞和免疫细胞,包括iNKT细胞。他们对这种干细胞进行了基因改造 ,使得它们经编程后产生iNKT细胞。他们在携带人类骨髓和人类癌症---多发性骨髓瘤(血癌)或黑色素瘤(实体瘤)---的小鼠上测试了所获得的细胞,即造血干细胞经过基因改造后产生的恒定自然杀伤细胞(hematopoietic stem cell-engineered invariant natural killer T cell, HSC-iNKT细胞),并研究了在HSC-iNKT细胞整合到骨髓后的小鼠免疫系统、癌症和HSC-iNKT细胞发生了什么。他们发现这些经过基因改造的造血干细胞可以正常分化为iNKT细胞,并在小鼠的余下的生命(通常大约一年)中继续产生iNKT细胞。
8.Nature:不对称溶酶体遗传预测造血干细胞的活化
doi:10.1038/s41586-019-1531
造血干细胞在整个生命周期中自我更新,并可以分化为所有的血细胞谱系,并能在移植后修复受损的血液系统。
近日来自苏黎世联邦理工学院(ETH Zurich)的带领一个多学科合作团队证明了细胞降解机器--包括溶酶体、自噬体、丝裂体和蛋白质NUMB--可以不对称地遗传到造血干细胞子细胞。这种不对称遗传预测了造血干细胞子细胞及其后代未来的不对称代谢和翻译活化以及命运。
因此,该研究为造血干细胞中不对称细胞分裂的存在提供了证据,相关研究成果于近日发表在Ntaure杂志上,题为"Asymmetric lysosome inheritance predicts activation of haematopoietic stem cells"。
9.Science子刊:对特定的造血干细胞亚群进行CRISPR-Cas9基因编辑可有效逆转多种血液疾病的症状
doi:10.1126/scitranslmed.aaw3768
在一项新的研究中,来自美国弗雷德哈钦森癌症研究中心等研究机构的研究人员利用CRISPR-Cas9对长寿的造血干细胞进行编辑,从而逆转在包括镰状细胞病和β地中海贫血在内的几种血液疾病中观察到的临床症状。这是科学家们首次对成体造血干细胞中的一个特定亚群的遗传组成进行特异性编辑,其中造血干细胞是血液和免疫系统中所有细胞的来源。相关研究结果近期发表在Science Translational Medicine期刊上,论文标题为“Therapeutically relevant engraftment of a CRISPR-Cas9–edited HSC-enriched population with HbF reactivation in nonhuman primates”。
在这项有望导致人体临床试验的临床前研究中,这些研究人员选择了一个与镰状细胞病和β-地中海贫血相关的基因,这两种血液疾病都是由血红蛋白产生中存在的遗传缺陷导致的。其他的研究已表明重新激活一种在胎儿发育过程中起作用的但在我们的第一个生日时就不再产生的血红蛋白版本---胎儿血红蛋白,就可逆转疾病症状。
这些研究人员利用CRISPR-Cas9基因编辑移除一部分通常会阻止胎儿血红蛋白产生的遗传密码。利用CRISPR切割这段控制性的DNA片段使得红细胞能够持续地产生升高水平的胎儿血红蛋白。
这些研究人员对靶向干细胞进行了高效编辑:在输注之前,78%的靶向干细胞在实验室培养皿中发生了编辑。一旦输注到体内后,这些经过编辑的干细胞在体内定植、增殖并产生血细胞,其中30%的血细胞含有经过编辑的遗传密码。这导致高达20%的红细胞携带胎儿血红蛋白,这种类型的血红蛋白可逆转镰状细胞病和地中海贫血中的疾病症状。
10.Nature:重大进展!28天内在体外将造血干细胞的数量扩大900倍,让无需接受调理治疗的造血干细胞移植成为可能
doi:10.1038/s41586-019-1244-x
在一项新的研究中,来自美国斯坦福大学和日本东京大学等研究机构的研究人员可能破解了在没有放疗和化疗的情况下进行干细胞移植和基因治疗的密码。
几十年来,科学家们在实验室中培养大量造血干细胞的尝试一直受阻。这些罕见的骨髓细胞单独负责产生血液和免疫系统中的所有细胞。培养这些细胞的困难严重阻碍了许多研究工作,包括那些让某些癌症或血液疾病患者更容易和更安全地接受干细胞移植或基因治疗的研究工作。
如今,这些研究人员破解了这些密码。通过调整培养这些细胞的营养液中的组分、用于支持它们生长的专门分子和培养它们所需的物理条件,他们首次证实诱导来自小鼠的造血干细胞在短短28天的时间内自我更新数百甚至数千次是可能的。
论文共同通讯作者、斯坦福大学遗传学教授Hiromitsu Nakauchi博士说道,“这是我作为干细胞研究员的人生目标之一。50年来,世界各地实验室的科学家们一直在寻找大量培养这些细胞的方法。如今,我们鉴定出一系列条件,足以让这些细胞的数量在短短一个月内扩大900倍。我们认为这种方法可能引发在人体中开展造血干细胞移植和基因治疗的变革。”
特别地,这些研究人员证实在不首先消除受者自身干细胞群体的情况下,成功地将大量体外培养的造血干细胞移植到小鼠体内是有可能的。如果这种技术也适用于人类,那么它可能在移植前让数千名患有血液疾病或免疫疾病的患者免受严格的放疗或化疗方案。它还可能允许临床医生利用患者自己的经过基因校正的干细胞进行基因治疗。
11.Hum Gene Ther:基因疗法治疗地中海贫血症效价分析
doi:10.1089/hum.2018.178
基因治疗有望治愈β-地中海贫血,而一项新的研究已经表明,与异基因造血干细胞移植(HSCT)治疗相比,基因治疗在2年内与更少的并发症和住院率有关。该研究分析和比较了基因治疗与HSCT对β-地中海贫血患者的有效性和成本,相关研究成果发表在《Human gene therapy》杂志上。
巴黎第七大学的Severine Coquerelle领导的一个法国研究团队完成了这项研究,题为“Innovative Curative Treatment of Beta Thalassemia: Cost-Efficacy Analysis of Gene Therapy Versus Allogenic Hematopoietic Stem-Cell Transplantation”。
接受HSCT治疗的患者发生感染性并发症的几率是其他患者的3倍。基因治疗的成本约为HSCT的2.8倍,其中近一半的基因治疗成本来自于载体的制备。
12.Stem Cell Rep:研究揭示红细胞和白细胞的来源
doi:10.1016/j.stemcr.2019.02.007
在近日发表在《Stem Cell Reports》上的一项新研究中,加州大学圣克鲁兹分校杰克巴斯金工程学院生物分子工程教授Camilla Forsberg的实验室克服了技术上的障碍,对造血干细胞产生的血细胞进行了全面的统计。他们的发现对于理解诸如贫血、免疫系统疾病以及血癌(如白血病和淋巴瘤)等疾病具有重要意义。
Forsberg说:“我们正试图了解血细胞和免疫细胞生产的平衡,这在许多疾病中都是失调的。”造血干细胞产生成熟血细胞的过程涉及到多个祖细胞群,这些祖细胞在发育成完全成熟的细胞时,会逐渐遵循特定的“命运”。道路上的一个主要岔路口在“淋巴祖细胞”和“髓祖细胞”之间,前者产生白细胞,后者产生其他种类的白细胞、红细胞和血小板。骨髓中的大多数细胞属于髓系。
这项新研究的一个关键发现是,所有具有骨髓潜能的祖细胞产生的红细胞都比任何其他类型的细胞多得多。这是令人惊讶的,因为许多以前的研究中,祖细胞在体外培养生长时,研究人员发现它们产生红细胞和血小板的能力有限。Forsberg说,这些结果现在看来是人工培养条件造成的。她说:“很多这样的实验很难理解,因为我们知道我们的身体需要制造大量的红细胞和血小板。我们的研究结果表明,这些祖细胞保留了大量的红细胞潜能。事实上,我们认为红细胞生成是默认的途径。”
在第一作者、Forsberg实验室的研究生Scott Boyer领导的实验中,研究人员将不同的祖细胞群移植到小鼠体内,追踪红细胞、血小板(血液的第二大成分)和免疫细胞的产生。Boyer还能够移植单个祖细胞,然后识别其产生的血液和免疫细胞。通过对从移植的祖细胞中产生的成熟血细胞数量进行量化,研究人员能够证明,除了淋巴祖细胞外,红细胞是迄今为止所有祖细胞中所产生的最丰富的细胞类型。
13.Science首发、NEJM和Nature子刊引用 揭秘胆固醇调节有望帮助开发新型心脏病疗法
doi:10.1126/science.aav1749
近日,发表在Science杂志上的研究报告中,来自休斯敦卫理公会研究所的科学家们进行了一项划时代的研究,他们揭示了引发高胆固醇个体机体中白细胞数量激增的原因,这或有望帮助开发治疗心脏病的新型疗法。
文章中,研究者Longhou Fang等人对一种名为高胆固醇血症(hypercholesterolemia)的疾病进行了研究,这是一种高胆固醇症,其会引发机体血液中循环的有害胆固醇水平过高。研究者利用斑马鱼模型进行研究鉴别出了一种新型调节机制,这种机制能够帮助解释为何LDL(低密度脂蛋白)水平较高的个体中白细胞水平往往较高,较高的LDL会增加个体患心血管疾病的风险,而心血管疾病是引发美国乃至全球人群发病和死亡的主要原因。
此外,研究者还发现了控制造血干细胞产生的新通路,其或能被用来治疗一系列血液疾病,比如白血病和贫血症等,一种来源于植物中的药物白桦脂醇(betulin)(SREBP2的抑制剂)或能被重新定向来减缓白血病的进程,同时研究者还能利用患者机体衍生的造血干细胞来消除对供体的需求,从而进行有效的骨髓移植。(生物谷 Bioon.com)
1988年法国的Gluckman教授在国际上率先成功采用脐血造血干细胞移植,救治了一名贫血患儿,标志着脐带血造血干细胞移植时代的开启。全球现每年约进行6万例骨髓移植术,其中使用自体和同种异体造血干细胞完成骨髓移植术的患者人数分别为近3.5万和2.5万例。
造血干细胞的来源主要包括骨髓、外周血和脐带血。如今,“骨髓移植”已渐渐被“外周血造血干细胞移植”代替。也就是说,现在捐赠骨髓已不再抽取骨髓,而只是“献血”了。 脐带血是胎儿娩出断脐后残留在脐带和胎盘中的血液,富含造血干细胞,可用于治疗急、慢性白血病和某些恶性肿瘤等多种重大疾病。
基于此,小编针对近年来造血干细胞研究取得的进展进行一番梳理,以飨读者。
1.eLife:神奇!一种抗关节炎药物竟可阻止结核杆菌在造血干细胞中增殖
doi:10.7554/eLife.47013
在一项新的研究中,来自比利时天主教鲁汶大学和巴西桑塔卡塔琳娜联邦大学的研究人员发现一种用于抵抗关节炎的药物也可以阻止一种允许结核杆菌感染并劫持造血干细胞的过程。相关研究结果于2019年10月22日发表在eLife期刊上,论文标题为“An evolutionary recent IFN-IL-6-CEBP axis is linked to monocyte expansion and tuberculosis severity in humans”。论文通讯作者为天主教鲁汶大学免疫学家Johan Van Weyenbergh和桑塔卡塔琳娜联邦大学免疫学家André Báfica。

图片来源:medium.com。
这些研究人员使用了来自健康捐献者骨髓和脐带血的造血干细胞。Van Weyenbergh说,“我们将这些造血干细胞放入试管中,并使其暴露于结核杆菌中。结果发生了两个过程:这种细菌感染了这些造血干细胞并开始在其中增殖。与此同时,这些造血干细胞将自身转化为 一类非常特殊的白细胞。在正常情况下,白细胞保护我们的身体免受感染,但是在这种情形下,它们被这种细菌劫持并成为它的理想宿主细胞。
好消息是,有一种方法可以阻止这个过程。Van Weyenbergh说:“我们对数据库进行了大规模的计算机分析,这些数据库具有对结核杆菌和造血干细胞都重要的基因。令我们吃惊的是,这种分析使得我们找到了一种抗关节炎的药物:托珠单抗(Tocilizumab)。在试管中 加入这种药物可以起到一箭双雕的作用:造血干细胞向宿主细胞的转化停止了,而且结核杆菌的增殖速率减慢了。”
2.JAMA:临床试验表明非清髓性自体造血干细胞移植有望治疗复发缓解型多发性硬化症
doi:10.1001/jama.2018.18743
非清髓性自体造血干细胞移植(nonmyeloablative autologous hematopoietic stem cell transplantation, 非清髓性自体HSCT)代表着一种减缓或预防的复发缓解型多发性硬化症(relapsing-remitting multiple sclerosis)的潜在有效方法,但是人们并不清楚它是 否优于疾病改善治疗(disease-modifying therapy, DMT)。
在一项新的临床研究中,为了比较非清髓性自体HSCT与DMT对疾病进展的影响,来自美国、瑞典、英国和巴西的研究人员开展了一项随机临床试验(临床试验登记号:NCT00273364)。结果发现,与DMT治疗相比,非清髓性自体HSCT治疗显著延长了病情进展时间。相关研究 结果近期发表在JAMA期刊上,论文标题为“Effect of Nonmyeloablative Hematopoietic Stem Cell Transplantation vs Continued Disease-Modifying Therapy on Disease Progression in Patients With Relapsing-Remitting Multiple Sclerosis”。
这些作者在2005年9月20日至2016年7月7日之间,在美国、欧洲和南美的4个中心共招募了110名复发缓解型多发性硬化症患者:在前一年接受DMT治疗后至少出现2次疾病复发;扩展残疾状态量表(Expanded Disability Status Scale, EDSS,评分范围为0到10,10为最严 重的神经神经残疾)的评分为2.0~6.0。这些作者对这些患者进行了随机分配。最后一次随访发生在2018年1月,数据库锁定发生在2018年2月。
在这110名随机分配的患者(73名[66%]妇女;平均年龄为36 [SD,8.6]岁)中,103人仍继续参加这项临床试验,其中98人在1年中接受评估,23人在5年中每年接受评估(中位随访2年;平均2.8年)。HSCT治疗组中的3名患者和DMT治疗组的34名患者发生了疾病进展。由 于发生的事件太少,HSCT治疗组无法计算中位进展时间。DMT治疗组的中位进展时间为24个月(四分位间距为18~48个月)(风险比为0.07; 95%CI为0.02-0.24;P <0.001)。在第一年,HSCT治疗组的EDSS平均评分从3.38降低到2.36,而DMT治疗组的平均EDSS评分从 3.31升高到3.98(组间平均差异为-1.7;95%CI为-2.03~-1.29; P <0.001)。没有患者死亡,而且接受HSCT治疗的患者没有出现非造血4级毒性事件(比如心肌梗塞,败血症或其他致残或潜在的危及生命的事件)。
3.Neurology:临床试验表明造血干细胞移植可逆转视神经脊髓炎
doi:10.1212/WNL.0000000000008394
在一项新的临床研究中,来自美国西北大学费恩柏格医学院和梅奥诊所的研究人员报道造血干细胞移植可逆转一种使人衰弱的神经系统疾病,这种称为视神经脊髓炎(neuromyelitis optica)的疾病导致一半的患者在确诊后5年内失明和失去行走的能力。大多数患者在接 受造血干细胞移植5年后保持良好,并且能够避免每年花费高达50万美元的药物治疗。相关研究结果近期发表在Neurology期刊上,论文标题为“Autologous nonmyeloablative hematopoietic stem cell transplantation for neuromyelitis optica”。

图片来自CC0 Public Domain。
在这项临床研究中,12名视神经脊髓炎患者接受了造血干细胞移植。在移植5年后,在这12名患者中,仅有2人发生疾病复发,不得不重新接受药物治疗。这似乎是造血干细胞移植可以逆转的第四种慢性疾病。
论文第一作者、西北大学费恩柏格医学院医学教授、免疫疗法与自身免疫疾病负责人Richard Burt博士说,“造血干细胞移植和药物治疗之间存在明显的区别。造血干细胞移植改善了患者的神经功能障碍和生活质量。他们的病情好转,而且疾病标志物AQP4在移植后长达 五年的时间里消失了。”
4.Blood:植物成分能够提高基因疗法的速度与有效性
doi:10.1182/blood.2019000040
目前,基因疗法的治疗过程需要从患者血液中分离出非常少量的造血干细胞。这些细胞可以自我更新并产生所有其他类型的血细胞。然后,治疗基因通过专门设计的病毒(称为“慢病毒载体”)导入到这些细胞中。
然而,造血干细胞对病毒攻击具有高度的抵抗力。它们借助于干扰素诱导的跨膜蛋白IFITM来保护自己,该蛋白会拦截慢病毒载体。因此,Torbett说,要成功地将基因传递到造血干细胞中,可能需要许多尝试-以及大量昂贵的基因治疗载体。
美国斯克里普斯研究所免疫学和微生物学系副教授Torbett博士他的团队发现,将白藜芦醇样化合物卡巴酚A与慢病毒载体混合物一起添加到人类造血干细胞中,这些细胞会丧失其天然防御能力,并使慢病毒载体更容易进入。一旦将经过处理的干细胞移植到小鼠体内,它 们就会分裂并产生包含新遗传信息的血细胞。
该方法的另一个主要优点是时间短:如果可以在更短的时间内完成血液干细胞的基因递送治疗,则可以更快地将细胞重新施用给患者。Torbett说,这不仅使患者的治疗更加方便,而且还有助于确保干细胞不会失去自我更新的特性。
5.Cell子刊:有趣!伟哥有望用于造血干细胞移植
doi:10.1016/j.stemcr.2019.09.004
在一项新的研究中,来自美国加州大学圣克鲁兹分校的研究人员开发出一种快速地获得用于骨髓移植的供体造血干细胞的新方法,这种方法联合使用万艾可(Viagra,俗称伟哥)和另一种称为普乐沙福(Plerixafor)的药物。相关研究结果于2019年10月10日在线发表在 Stem Cell Reports期刊上,论文标题为“Viagra Enables Efficient, Single-Day Hematopoietic Stem Cell Mobilization”。

图片来自Stem Cell Reports, 2019, doi:10.1016/j.stemcr.2019.09.004。
骨髓移植主要用于治疗癌症,是一种挽救生命的治疗方案,它可在患者的一生当中恢复产生新血细胞的造血干细胞。这些造血干细胞通常仅存在于骨髓中。为了获得用于骨髓移植的造血干细胞,人们最初需要在髋骨上钻孔并使用一种特殊的针从骨髓中直接取出造血干细 胞。如今,更常见的是使用药物让造血干细胞从骨髓进入血液中,然后从血液中收集它们。
用于将造血干细胞从骨髓动员到血液中的标准药物方案需要连续数天注射粒细胞集落刺激因子(GCSF),然后收集造血干细胞,这种收集通常是在注射GCSF 4至6天后进行的。尽管这种方法的侵入性不如直接从骨髓中提取造血干细胞,但是它并不总是成功的,而且经常会 引起骨痛和其他副作用,这会让许多可能会从骨髓移植中受益的患者无法耐受。
这项新研究展示了另一种替代方案,该方案可在2小时内动员骨髓中的造血干细胞。它涉及在口服单剂伟哥,两小时后注射一剂普乐沙福。论文通讯作者、加州大学圣克鲁兹分校生物分子工程教授Camilla Forsberg说,“我们的方法可能极大地增加受益于骨髓移植的患者 数量。尽管已有方法做到这一点,但是标准药物方案并不适合所有人。”
6.Science子刊:毒蕈碱乙酰胆碱受体调节早期红细胞祖细胞的自我更新
doi:10.1126/scitranslmed.aaw3781
成体干细胞和祖细胞具有独特的自我更新能力,靶向这一过程代表着潜在的治疗机会。早期的红细胞祖细胞,即爆发形成单位红细胞(burst-forming unit erythroid,BFU-E),具有巨大的自我更新潜力,是治疗贫血的关键细胞类型。然而,研究人员们目前对BFU-E自我 更新机制的了解非常有限。
在一项近日发表在《Science Translational Medicine》上的最新研究中,来自冷泉港实验室和Memorial Sloan Kettering癌症中心(MSKCC)等单位的研究人员合作,发现毒蕈碱乙酰胆碱受体、胆碱能受体、毒蕈碱4 (CHRM4)通路调节BFU-E的自我更新,而对CHRM4的药理 学抑制纠正了骨髓增生异常综合征(myelodysplastic syndrome,MDS)的贫血、衰老和溶血。
研究人员发现使用遗传学手段下调CHRM4或者选择性拮抗剂PD102807抑制CHRM4可促进BFU-E自我更新,而在体内应激条件下,删除CHRM4可增加红细胞生成。此外,研究人员还发现毒蕈碱乙酰胆碱受体拮抗剂纠正了小鼠体内MDS、衰老和溶血模型的贫血,延长了MDS小鼠的 生存期。
通过机制研究,研究人员发现毒蕈碱受体拮抗剂促进BFU-Es扩增的作用是通过循环AMP诱导转录因子CREB介导的,其作用靶点是上调BFU-E自我更新的关键调节因子。
7.Cell Stem Cell:经过基因改造的HSC-iNKT细胞提供持久的抗肿瘤免疫反应
doi:10.1016/j.stem.2019.08.004
恒定自然杀伤细胞(invariant natural killer T cell, iNKT)称为免疫系统的“特种部队”。尽管它们在体内相对较少,但是它们要比许多其他的免疫细胞功能强大。在一项针对小鼠的研究中,来自美国加州大学洛杉矶分校的研究人员发现他们可以利用iNKT细胞的功 能攻击肿瘤细胞并治疗癌症。这种方法可以抑制移植到小鼠体内的多种类型人类肿瘤的生长。相关研究结果发表在2019年10月3日的Cell Stem Cell期刊上,论文标题为“Development of Hematopoietic Stem Cell-Engineered Invariant Natural Killer T Cell Therapy for Cancer”。论文通讯作者为加州大学洛杉矶分校伊莱-艾迪斯布罗德再生医学与干细胞研究中心成员Lili Yang。论文第一作者为加州大学洛杉矶分校的Yanni Zhu和Drake Smith。

图片来自CC0 Public Domain。
这些研究人员的目标是开发一种能永久性地增强人体自然产生更多iNKT细胞能力的疗法。他们从造血干细胞开始,其中造血干细胞是在骨髓中发现的细胞,它们可以自我复制,并可以变成所有类型的血细胞和免疫细胞,包括iNKT细胞。他们对这种干细胞进行了基因改造 ,使得它们经编程后产生iNKT细胞。他们在携带人类骨髓和人类癌症---多发性骨髓瘤(血癌)或黑色素瘤(实体瘤)---的小鼠上测试了所获得的细胞,即造血干细胞经过基因改造后产生的恒定自然杀伤细胞(hematopoietic stem cell-engineered invariant natural killer T cell, HSC-iNKT细胞),并研究了在HSC-iNKT细胞整合到骨髓后的小鼠免疫系统、癌症和HSC-iNKT细胞发生了什么。他们发现这些经过基因改造的造血干细胞可以正常分化为iNKT细胞,并在小鼠的余下的生命(通常大约一年)中继续产生iNKT细胞。
8.Nature:不对称溶酶体遗传预测造血干细胞的活化
doi:10.1038/s41586-019-1531
造血干细胞在整个生命周期中自我更新,并可以分化为所有的血细胞谱系,并能在移植后修复受损的血液系统。
近日来自苏黎世联邦理工学院(ETH Zurich)的带领一个多学科合作团队证明了细胞降解机器--包括溶酶体、自噬体、丝裂体和蛋白质NUMB--可以不对称地遗传到造血干细胞子细胞。这种不对称遗传预测了造血干细胞子细胞及其后代未来的不对称代谢和翻译活化以及命运。
因此,该研究为造血干细胞中不对称细胞分裂的存在提供了证据,相关研究成果于近日发表在Ntaure杂志上,题为"Asymmetric lysosome inheritance predicts activation of haematopoietic stem cells"。
9.Science子刊:对特定的造血干细胞亚群进行CRISPR-Cas9基因编辑可有效逆转多种血液疾病的症状
doi:10.1126/scitranslmed.aaw3768
在一项新的研究中,来自美国弗雷德哈钦森癌症研究中心等研究机构的研究人员利用CRISPR-Cas9对长寿的造血干细胞进行编辑,从而逆转在包括镰状细胞病和β地中海贫血在内的几种血液疾病中观察到的临床症状。这是科学家们首次对成体造血干细胞中的一个特定亚群的遗传组成进行特异性编辑,其中造血干细胞是血液和免疫系统中所有细胞的来源。相关研究结果近期发表在Science Translational Medicine期刊上,论文标题为“Therapeutically relevant engraftment of a CRISPR-Cas9–edited HSC-enriched population with HbF reactivation in nonhuman primates”。
在这项有望导致人体临床试验的临床前研究中,这些研究人员选择了一个与镰状细胞病和β-地中海贫血相关的基因,这两种血液疾病都是由血红蛋白产生中存在的遗传缺陷导致的。其他的研究已表明重新激活一种在胎儿发育过程中起作用的但在我们的第一个生日时就不再产生的血红蛋白版本---胎儿血红蛋白,就可逆转疾病症状。
这些研究人员利用CRISPR-Cas9基因编辑移除一部分通常会阻止胎儿血红蛋白产生的遗传密码。利用CRISPR切割这段控制性的DNA片段使得红细胞能够持续地产生升高水平的胎儿血红蛋白。
这些研究人员对靶向干细胞进行了高效编辑:在输注之前,78%的靶向干细胞在实验室培养皿中发生了编辑。一旦输注到体内后,这些经过编辑的干细胞在体内定植、增殖并产生血细胞,其中30%的血细胞含有经过编辑的遗传密码。这导致高达20%的红细胞携带胎儿血红蛋白,这种类型的血红蛋白可逆转镰状细胞病和地中海贫血中的疾病症状。
10.Nature:重大进展!28天内在体外将造血干细胞的数量扩大900倍,让无需接受调理治疗的造血干细胞移植成为可能
doi:10.1038/s41586-019-1244-x
在一项新的研究中,来自美国斯坦福大学和日本东京大学等研究机构的研究人员可能破解了在没有放疗和化疗的情况下进行干细胞移植和基因治疗的密码。

图片来自Nature (2019),doi:10.1038/s41586-019-1244-x。
几十年来,科学家们在实验室中培养大量造血干细胞的尝试一直受阻。这些罕见的骨髓细胞单独负责产生血液和免疫系统中的所有细胞。培养这些细胞的困难严重阻碍了许多研究工作,包括那些让某些癌症或血液疾病患者更容易和更安全地接受干细胞移植或基因治疗的研究工作。
如今,这些研究人员破解了这些密码。通过调整培养这些细胞的营养液中的组分、用于支持它们生长的专门分子和培养它们所需的物理条件,他们首次证实诱导来自小鼠的造血干细胞在短短28天的时间内自我更新数百甚至数千次是可能的。
论文共同通讯作者、斯坦福大学遗传学教授Hiromitsu Nakauchi博士说道,“这是我作为干细胞研究员的人生目标之一。50年来,世界各地实验室的科学家们一直在寻找大量培养这些细胞的方法。如今,我们鉴定出一系列条件,足以让这些细胞的数量在短短一个月内扩大900倍。我们认为这种方法可能引发在人体中开展造血干细胞移植和基因治疗的变革。”
特别地,这些研究人员证实在不首先消除受者自身干细胞群体的情况下,成功地将大量体外培养的造血干细胞移植到小鼠体内是有可能的。如果这种技术也适用于人类,那么它可能在移植前让数千名患有血液疾病或免疫疾病的患者免受严格的放疗或化疗方案。它还可能允许临床医生利用患者自己的经过基因校正的干细胞进行基因治疗。
11.Hum Gene Ther:基因疗法治疗地中海贫血症效价分析
doi:10.1089/hum.2018.178
基因治疗有望治愈β-地中海贫血,而一项新的研究已经表明,与异基因造血干细胞移植(HSCT)治疗相比,基因治疗在2年内与更少的并发症和住院率有关。该研究分析和比较了基因治疗与HSCT对β-地中海贫血患者的有效性和成本,相关研究成果发表在《Human gene therapy》杂志上。
巴黎第七大学的Severine Coquerelle领导的一个法国研究团队完成了这项研究,题为“Innovative Curative Treatment of Beta Thalassemia: Cost-Efficacy Analysis of Gene Therapy Versus Allogenic Hematopoietic Stem-Cell Transplantation”。
接受HSCT治疗的患者发生感染性并发症的几率是其他患者的3倍。基因治疗的成本约为HSCT的2.8倍,其中近一半的基因治疗成本来自于载体的制备。
12.Stem Cell Rep:研究揭示红细胞和白细胞的来源
doi:10.1016/j.stemcr.2019.02.007
在近日发表在《Stem Cell Reports》上的一项新研究中,加州大学圣克鲁兹分校杰克巴斯金工程学院生物分子工程教授Camilla Forsberg的实验室克服了技术上的障碍,对造血干细胞产生的血细胞进行了全面的统计。他们的发现对于理解诸如贫血、免疫系统疾病以及血癌(如白血病和淋巴瘤)等疾病具有重要意义。
Forsberg说:“我们正试图了解血细胞和免疫细胞生产的平衡,这在许多疾病中都是失调的。”造血干细胞产生成熟血细胞的过程涉及到多个祖细胞群,这些祖细胞在发育成完全成熟的细胞时,会逐渐遵循特定的“命运”。道路上的一个主要岔路口在“淋巴祖细胞”和“髓祖细胞”之间,前者产生白细胞,后者产生其他种类的白细胞、红细胞和血小板。骨髓中的大多数细胞属于髓系。
这项新研究的一个关键发现是,所有具有骨髓潜能的祖细胞产生的红细胞都比任何其他类型的细胞多得多。这是令人惊讶的,因为许多以前的研究中,祖细胞在体外培养生长时,研究人员发现它们产生红细胞和血小板的能力有限。Forsberg说,这些结果现在看来是人工培养条件造成的。她说:“很多这样的实验很难理解,因为我们知道我们的身体需要制造大量的红细胞和血小板。我们的研究结果表明,这些祖细胞保留了大量的红细胞潜能。事实上,我们认为红细胞生成是默认的途径。”
在第一作者、Forsberg实验室的研究生Scott Boyer领导的实验中,研究人员将不同的祖细胞群移植到小鼠体内,追踪红细胞、血小板(血液的第二大成分)和免疫细胞的产生。Boyer还能够移植单个祖细胞,然后识别其产生的血液和免疫细胞。通过对从移植的祖细胞中产生的成熟血细胞数量进行量化,研究人员能够证明,除了淋巴祖细胞外,红细胞是迄今为止所有祖细胞中所产生的最丰富的细胞类型。
13.Science首发、NEJM和Nature子刊引用 揭秘胆固醇调节有望帮助开发新型心脏病疗法
doi:10.1126/science.aav1749
近日,发表在Science杂志上的研究报告中,来自休斯敦卫理公会研究所的科学家们进行了一项划时代的研究,他们揭示了引发高胆固醇个体机体中白细胞数量激增的原因,这或有望帮助开发治疗心脏病的新型疗法。
文章中,研究者Longhou Fang等人对一种名为高胆固醇血症(hypercholesterolemia)的疾病进行了研究,这是一种高胆固醇症,其会引发机体血液中循环的有害胆固醇水平过高。研究者利用斑马鱼模型进行研究鉴别出了一种新型调节机制,这种机制能够帮助解释为何LDL(低密度脂蛋白)水平较高的个体中白细胞水平往往较高,较高的LDL会增加个体患心血管疾病的风险,而心血管疾病是引发美国乃至全球人群发病和死亡的主要原因。
此外,研究者还发现了控制造血干细胞产生的新通路,其或能被用来治疗一系列血液疾病,比如白血病和贫血症等,一种来源于植物中的药物白桦脂醇(betulin)(SREBP2的抑制剂)或能被重新定向来减缓白血病的进程,同时研究者还能利用患者机体衍生的造血干细胞来消除对供体的需求,从而进行有效的骨髓移植。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


