乙肝功能性治愈!新型双特异性蛋白免疫疗法IMC-I190V进入临床试验:重新定向T细胞,清除HBV感染的细胞!
来源:本站原创 2021-05-20 02:05
IMC-I190V旨在使免疫系统识别并消除病毒感染的细胞,基于ImmTAV(针对病毒的免疫动员单克隆T细胞受体)技术开发。

2021年05月20日讯 /生物谷BIOON/ --Immunocore是一家临床阶段的生物技术公司,开创了一类新型T细胞受体(TCR)双特异性免疫疗法。近日,该公司宣布,评估IMC-I109V治疗慢性乙型肝炎病毒(HBV)感染者(CHB)的首个人体临床试验已对第一例患者进行了给药治疗。这项试验是一项开放标签研究,将在非肝硬化、乙型肝炎抗原阴性、实现病毒抑制的HLA-A*02:01阳性慢性HBV感染者中评估IMC-I190V的安全性、抗病毒活性和药代动力学。
该研究的首席调查员、中国香港大学玛丽医院医学部胃肠病和肝病科主任袁孟峰(Man-Fung Yuen)教授表示:“我们的目的是,通过这项研究,获得进一步的数据,评估这种双特异性T细胞受体(TCR)的安全性和潜力,为慢性乙型肝炎患者提供功能性治愈。全世界大约三分之一的人口有过去或现在感染乙肝病毒(HBV)的血清学证据,2.4亿人是HBV的慢性携带者。在慢性乙型肝炎(CHB)患者中,25%会发展为原发性肝癌或肝硬化。目前的治疗方案需要终生坚持才能有效,因此迫切需要新的和创新的治疗方案。”
IMC-I190V是一种新型双特异性蛋白免疫疗法,目前正被开发用于治疗慢性乙型肝炎(CHB)。IMC-I190V由Immunocore全资拥有,是采用该公司抗病毒免疫动员单克隆T细胞受体(ImmTAV)平台开发并进入人体临床试验的第一个候选药物。
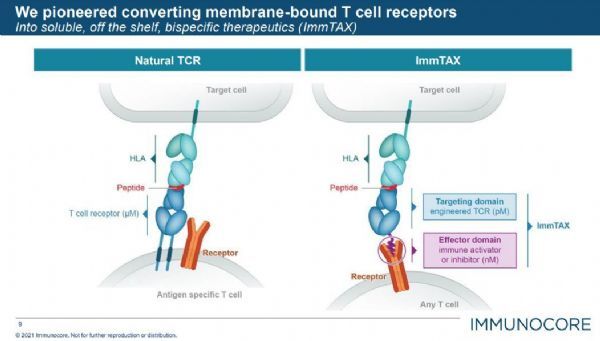
ImmTAV(针对病毒的免疫动员单克隆TCR)分子是一种新型双特异性分子,与ImmTAC(针对癌症的免疫动员单克隆TCR)分子一样,旨在使免疫系统识别并消除病毒感染的细胞。
ImmTAX分子结构特点(点击图片,查看大图)
目前,基于ImmTAC技术开发的创新疗法tebentafusp已处于3期临床,并在一线治疗转移性葡萄膜黑色素瘤(mUM)方面展现强大疗效:与研究者选定的治疗方案(82%为默沙东抗PD-1疗法Keytruda[可瑞达])相比,tebentafusp显著延长总生存期(21.7个月 vs 16.0个月)、将死亡风险显著降低49%(HR=0.51,p<0.0001)。
IMC-I109V是一种免疫治疗方法,旨在通过T细胞的重新定向,特异性地清除HBV感染的表达乙型肝炎表面抗原(HBsAg)的肝细胞。IMC-I109V旨在通过招募非衰竭性T细胞(non-exhausted T cell)来消除含有共价闭合环状DNA或整合HBV-DNA的肝细胞,从而克服T细胞功能障碍。消除这些细胞是实现“功能性治愈”状态的必要条件。在乙肝治疗中,“功能性治愈”定义为:治疗后6个月检测不到HBVDNA以及持续的HBsAg丢失。
Immunocore的目标是在慢性乙型肝炎(CHB)患者停止用药后,实现血液循环病毒抗原和病毒复制标志物的持续丢失,即所谓的“功能性治愈”。
乙肝功能性治愈——策略(点击图片,查看大图)
ImmTAC(抗肿瘤免疫动员单克隆T细胞受体)是Immunocore公司的核心技术,这是一种新型的双特异性生物大分子,由工程化改造的T细胞受体(TCR)以及抗CD3的scFv组成,其中:改造后的TCR能以显著提高的亲和力(比抗原抗体亲和力高出9倍)特异性识别并结合肿瘤细胞表面的抗原肽-人类白细胞抗原复合物(pHLA),抗CD30的scFv则能够吸引、招募T细胞至肿瘤细胞周围并激活T细胞发挥肿瘤杀伤作用。
ImmTAC旨在通过结合TCR系统和抗CD3效应器功能来激活对癌细胞的高效特异性T细胞反应,从而克服其他免疫肿瘤学药物的局限性。凭借ImmTAC技术,Immunocore公司已与包括罗氏、葛兰素史克、礼来、阿斯利康在内的多家制药巨头达成了广泛的免疫肿瘤学合作。
tebentafusp(IMCgp100)是临床推进最快的一种ImmTAC,旨在特异性靶向黑色素瘤相关抗原gp100并使T细胞直接针对癌细胞产生强效和特异性反应。目前,tebentafusp治疗葡萄膜黑色素瘤(UM)已处于3期临床。
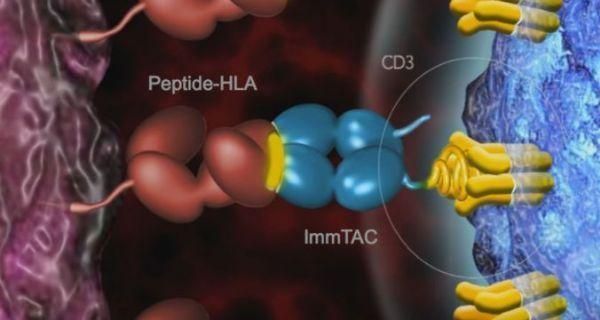
ImmTAC
今年4月,tebentafusp一线治疗转移性葡萄膜黑色素瘤(mUM)3期IMCgp100-202临床试验(NCT03070392)的阳性结果公布。该研究在既往未接受治疗的(初治)mUM患者中开展,共378例患者按2:1的比例随机分配至tebentafusp(研究组)或研究者选定的治疗选择(对照组)。该研究中,研究者选定的治疗方案包括:达卡巴嗪,抗CTLA-4疗法Yervoy(ipilimumab,易普利姆玛),抗PD-1疗法Keytruda(可瑞达)。研究主要终点是总生存期(OS)。
结果显示,在意向性治疗(ITT)人群中,中位随访14.1个月,与研究者选定方案(82%患者接受Keytruda,12%患者接受Yervoy,6%患者接受达卡巴嗪)相比,tebentafusp显著延长总生存期(21.7个月 vs 16.0个月)、将死亡风险降低了49%(HR=0.51;95%CI:0.36-0.71;p<0.0001)。tebentafusp治疗组1年生存率为73.2%,而研究者选定方案组为58.5%。
这些疗效数据证实了在既往接受过治疗(经治)的mUM患者中开展的2期IMCgp100-102研究中观察到的有希望的OS数据。此外,与研究者选定方案组相比,tebentafusp治疗组疾病进展或死亡风险(PFS)显著降低了27%(中位PFS:3.3个月 vs 2.9个月;HR=0.73;p=0.0139)。该研究中,与治疗相关的不良事件是可控的,并与提议的作用机制一致。
值得一提的是,这是针对任何TCR疗法获得阳性结果的首个3期临床试验,也是任何双特异性疗法在实体瘤中的首个阳性3期临床试验。mUM患者预后很差,几十年来情况没有明显改变。
基于IMCgp100-202研究的强劲疗效结果,Immunocore公司将与美国FDA合作,在2021年第三季度完成tebentafusp生物制品许可申请(BLA)的提交。如果获得批准,tebentafusp将成为40年来治疗mUM方面第一个显著改善总生存期(OS)的新疗法。(生物谷Bioon.com)
原文出处:Immunocore announces dosing of first patient with ImmTAV? bispecific molecule for chronic Hepatitis B
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->