2021年4月Science期刊不得不看的亮点研究
来源:本站原创 2021-04-30 23:57
2021年4月30日讯/生物谷BIOON/---2021年4月份即将结束了,4月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
2021年4月30日讯/生物谷BIOON/---2021年4月份即将结束了,4月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.Science:阻止成纤维细胞的Engrailed-1基因激活可使皮肤伤口愈合而不留下疤痕
doi:10.1126/science.aba2374; doi:10.1126/science.abi5770
皮肤伤口一般通过形成疤痕来愈合,这是一种由表达Engrailed-1(En1)基因的成纤维细胞谱系介导的纤维化过程。疤痕在三个方面与正常未受伤的皮肤不同:(i) 它们缺乏毛囊、皮脂腺和其他真皮附属物(dermal appendage);(ii) 它们含有密集的、平行的细胞外基质纤维,而不是未受伤皮肤的“篮筐编织(basket-weave)”模式;(iii) 由于这种基质结构的改变,它们缺乏皮肤的正常弹性和强度。一种成功的疤痕疗法将通过促进真皮附属物的重新生长、正常的基质超微结构的重建和机械强度的恢复来解决这三个差异。然而,人们对阻碍出生后皮肤再生性愈合反应的细胞和分子机制知之甚少,也不知道是否可以通过调节特定的成纤维细胞谱系来绕过这些机制。
在一项新的研究中,来自美国斯坦福大学医学院的研究人员想要了解疤痕成纤维细胞(scarring fibroblast, ,也称为瘢痕成纤维细胞)是否纯粹来自于未受伤皮肤中现有的En1阳性成纤维细胞的扩增,或者En1阳性疤痕成纤维细胞是否可以通过激活出生后的En1阴性成纤维细胞在伤口微环境(wound niche)中的En1表达而从新产生。相关研究结果发表在2021年4月23日的Science期刊上,论文标题为“Preventing Engrailed-1 activation in fibroblasts yields wound regeneration without scarring”。

皮肤成纤维细胞中的Engrailed-1激活导致疤痕形成,图片来自Science, 2021, doi:10.1126/science.aba2374。
成纤维细胞移植和谱系追踪研究显示,网状真皮层的En1阴性成纤维细胞(ENF)在伤口微环境中激活En1,产生了大约40%~50%的疤痕成纤维细胞。这一现象取决于机械线索:在软基质上培养的ENF细胞或用机械信号蛋白(比如YAP)的化学抑制剂处理的ENF细胞不会激活En1。通过RNA测序对表达En1的ENF细胞和用短发夹RNA(shRNA)进行En1敲降的ENF细胞进行比较,结果表明En1调节一系列与皮肤纤维化有关的基因。
在愈合的伤口中,通过维替泊芬(verteporfin)抑制YAP,阻断En1激活,可促进ENF细胞介导的修复,在30天内实现皮肤再生,并伴随功能性毛囊和皮脂腺的恢复。对疤痕和再生皮肤的定量比较表明,YAP抑制诱导恢复正常的真皮超微结构,进而使得正常的机械断裂强度得到恢复。白喉毒素介导的出生后表达En1的成纤维细胞的剔除和针对成纤维细胞的转基因YAP敲除同样促进了正常皮肤结构的恢复,这表明对En1激活的调控,无论是直接方式还是间接方式,都能导致伤口再生。
2.Science:新研究揭示纹状体多巴胺升高可导致幻觉
doi:10.1126/science.abf4740; doi:10.1126/science.abh1310
精神分裂症等精神疾病(psychotic disorder)给人类、社会和经济带来巨大负担。过去几十年来,由于科学家们对潜在神经生物学的理解仍然停滞不前,精神疾病的预后并没有取得实质性的改善。事实上,幻觉的主观性是精神疾病的一种定义性症状,这为在人类中的严格研究和转化为临床前动物模型带来了持久的挑战。
在一项新的研究中,来自美国冷泉港实验室和华盛顿大学医学院的研究人员开发出一种跨物种的计算精神疾病方法,从而直接将人类和啮齿类动物的行为联系起来,并利用这种方法研究小鼠幻觉样知觉(hallucination-like perception)的神经基础。相关研究结果发表在2021年4月2日的Science期刊上,论文标题为“Striatal dopamine mediates hallucination-like perception in mice”。
他们设计了一种计算模型,用于解释当先前的期望大于感觉证据时,幻觉样知觉的出现是错误的知觉推断的结果。这种模型阐明了幻觉样知觉是如何从两种不同类型的期望的波动中产生的:奖赏期望(reward expectation)和知觉期望(perceptual expectation)。在小鼠中,
腹侧纹状体中的多巴胺波动反映了奖赏期望,而在纹状体尾部中的多巴胺波动反映了知觉期望。他们利用光遗传学手段增加了纹状体尾部中
的多巴胺,观察到多巴胺的增加引起了幻觉样知觉。这种影响可通过给送氟哌啶醇(haloperidol, 一种阻断D2多巴胺受体的抗精神疾病药
物)来拯救。
3.Science:间歇性“休整”通过表观遗传学重塑过程恢复CAR-T细胞功能
doi:10.1126/science.aba1786; doi:10.1126/science.abh0583
嵌合抗原受体T细胞疗法(简称 “CAR-T”)正越来越多地被应用于肿瘤患者的治疗。 CAR-T细胞疗法在血液系统癌症患者中显示出令人鼓舞
的结果,但其抗癌活性可能受到CAR-T细胞功能有效性的限制。 在最近一项研究中,来自斯坦福大学医学院的Crystal L. Mackall教授课题组表征了连续活动引起的CAR-T细胞衰竭相关的表型和表观基因组变化,以及短暂休息对于恢复其功能的有益作用。作者测试了不同类型的“
间歇性休息”处理,例如使用药物dasatinib暂时抑制T细胞活性,这有助于防止CAR-T细胞衰竭并能够有效改善小鼠模型中的CAR-T细胞抗肿瘤活性。相关结果发表在最近的《Science》杂志上。
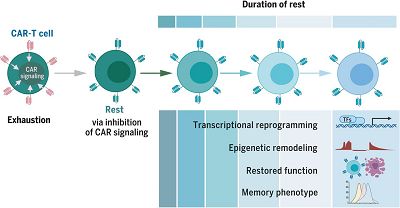
给衰竭CAR-T细胞提供“刹车”,图片来自Science, 2021, doi:10.1126/science.aba1786。
此外,作者通过诱导“衰竭”的CAR-T细胞间歇性静息,它们的命运从衰竭转移到记忆样状态。在已经具有“衰竭”特征的CAR-T细胞中,静息诱 导仅4天就使其表型逆转,并诱导转录重编程和整体表观遗传重塑。此外,“衰竭”的CAR-T细胞经过休息后,其抗肿瘤活性得到充分地恢复, 功能恢复的程度与休息的时间长短有关,并且与疲惫相关的转录因子TOX的表达减少和记忆相关的转录因子LEF1和TCF1的表达增加有关。
之后,作者发现CAR-T细胞功能的恢复取决于组蛋白甲基转移酶EZH2的活性,这与表观遗传重塑的现象相符。通过使用小鼠肿瘤移植模型, 作者发现:与对照CAR-T细胞相比,通过CAR表达的振荡或dasatinib在体内进行诱导间歇性“休整”的CAR-T细胞表现出更好的抗肿瘤能力和更 高的存活率。单细胞分析表明,单次dasatinib刺激足以诱导“衰竭”的肿瘤浸润性CAR-T细胞产生记忆表型并增强其抗肿瘤功能。
4.Science:重大突破!千万不要单个拆散,不然我就投毒!我国科学家揭示CRISPR-Cas系统对宿主细胞成瘾机制
doi:10.1126/science.abe5601
在目前的基因组序列数据库中,约40%的细菌和约90%的古细菌基因组携带CRISPR-Cas位点,这表明除了适应性免疫的直接益处外,可能还存在减轻CRISPR系统的成本并防止其损失的机制。在一项新的研究中,来自中国科学院、中国科学院大学和四川师范大学等研究机构的研究人员特别研究了一种古细菌I-B型CRISPR-Cas系统,它包括一个长311个碱基对(bp)的基因间区域,在这种系统中,编码CRISPR效应物Cascade亚基的基因不能单独剔除,但可以很容易地作为一个整体剔除。这些观察结果表明,Cascade基因盒(cas6-cas8-cas7-cas5)包括一个有毒成分,使其对宿主成瘾(一旦任何一个cascade基因被剔除就会引起细胞毒性)。相关研究结果发表在2021年4月30日的Science期刊上,论文标题为“Toxin-antitoxin RNA pairs safeguard CRISPR-Cas systems”。
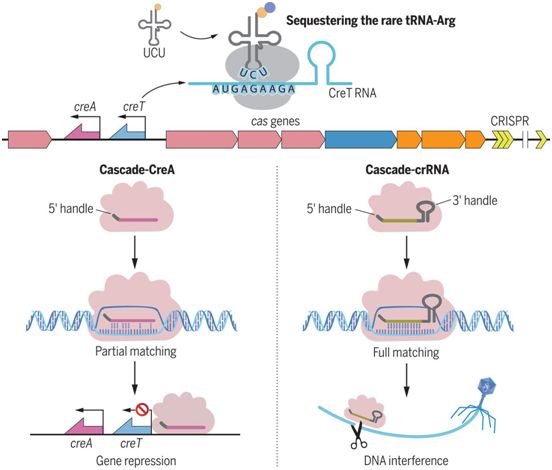
毒素-抗毒素RNA对CreTA保护CRISPR-Cas,图片来自Science, 2021, doi:10.1126/science.abe5601。
cas6和cas8之间的这个基因间序列在缺乏一个或多个cascade基因的细胞中引起毒性。通过广泛的突变分析,这些作者确定了RNA毒素基因creT及其关键序列元件,即一个强大的Shine-Dalgarno基序、一个有效的起始密码子、两个紧靠下游的小精氨酸密码子(AGA)和一个稳定的茎环结构的组合。tRNAUCU的过量表达缓解了CreT的毒性,这就支持一种机制,即这种RNA毒素通过隔绝稀少的精氨酸tRNAUCU来阻止细胞生长。
对CreT及其相邻序列的突变分析显示,相邻的CRISPR重复序列样序列是抑制CreT毒性所必需的。这个CRISPR重复序列样序列之后紧接着是一个间隔序列样序列(spacer-like sequence)和一个转录终止子。通过Northern印迹和RNA测序,这些作者证实了CreA RNA---一种缺乏3′柄的CRISPR RNA变体---的表达。CreA的间隔序列样序列与creT的启动子(PcreT)部分匹配,而且通过使用一个报告基因,他们证实当与Cascade形成复合物时,CreA抑制PcreT。与CRISPR干扰类似的是,对creT的抑制需要间隔序列邻近基序(protospacer adjacent motif, PAM)和PAM-近端碱基配对。在缺乏CreTA的细胞中,cascade基因容易受到转座因子的破坏。他们的生物信息学分析确定了多个与不同的古细菌和细菌CRISPR-cas位点相关并且含有与各自CRISPR系统相对应的PAM的CreTA类似物。值得注意的是,这些CreTA类似物在核酸序列上几乎没有保守性,这表明它们已经高度分歧地进化,因此可以想象,它们利用了不同的毒性机制。
5.Science:我国科学家从结构上揭示预起始复合物在核心启动子上的组装机制
doi:10.1126/science.aba8490
RNA聚合酶II(Pol II)介导的转录起始需要组装一种预起始复合物(preinitiation complex, PIC),在此期间,14个亚基的转录因子IID(TFIID)识别核心启动子并招募TFIIA、TFIIB、TFIIE、TFIIF、TFIIH和Pol II,依次组装核心PIC(core PIC, cPIC)、中间PIC(intermediate PIC, mPIC)和全PIC(holo PIC, hPIC)。教科书上的转录起始模型是从TBP(TATA框结合蛋白,TFIID的一个亚基)与TATA框的结合开始的。然而,多达85%的编码基因缺乏共有的TATA框,而且几乎所有Pol II介导的基因转录都需要TFIID复合物。尽管对基于TBP的PIC在TATA框启动子上进行了广泛的结构研究,但TFIID如何支持PIC在不同启动子上的组装仍然是不清楚的。
在一项新的研究中,来自中国复旦大学的研究人员重建了基于TFIID的人PIC,并解析出它的低温电镜结构。在13个不同的(天然的、复合的和突变的)启动子上,通过25种处于不同组成和构象状态的复合物结构来描述PIC的逐步组装。Pol II、TFIID模块和TBP-启动子在近原子分辨率下的结构允许进行详细的结构分析。相关研究结果发表在2021年4月30日的Science期刊上,论文标题为“Structural insights into preinitiation complex assembly on core promoters”。
不同构象下的结构显示了一种共同的TFIID结合模式,以及TBP加载在TATA框启动子(TATA promoter)和无TATA框的启动子(TATA-less promoter)上。出乎意料的是,TBP在PIC中类似地让TATA框和无TATA框的启动子弯曲。不同启动子上的PIC组装在cPIC处分化为两条轨道,在hPIC处汇合。在第一轨道上,TATA-DBE启动子上的cPIC、mPIC和hPIC分别采用Park、Neutral和Drive构象,表明启动子逐步沉积到Pol II,并伴随着广泛的模块重组。在第二轨道上,纯TATA框启动子(TATA-only promoter)和无TATA框启动子上的cPIC、mPIC和hPIC采用Drive构象,表明发生直接启动子沉积。
这些差异来自不同的启动子组成,导致启动子上“匹配”的模块与“重新定位”的模块分离,并导致不同的PIC结构和启动子轨迹。在hPIC中,TFIID稳定化PIC组装,支持细胞周期蛋白依赖性激酶7(CDK7)加载到Pol II上和CDK7介导的羧基端结构域(CTD)磷酸化。
6.Science:新研究揭示肠道杯状细胞的多样性,并发现隐窝间杯状细胞亚群对维持结肠粘液屏障功能至关重要
Science, 2021, doi:10.1126/science.abb1590
人体与其肠道微生物之间的错综复杂的平衡对人类健康至关重要。宿主与微生物相互作用的一个关键界面发生在覆盖肠道上皮表面的粘液中。在结肠中,粘液层作为一种屏障,抑制了上皮与密集的微生物群体的直接接触。这一系统存在缺陷是结肠炎的标志。粘液层在结构上依赖于高分子粘蛋白MUC2,它是由杯状细胞(goblet cell, GC)---通常被视为同质细胞类型的特殊分泌细胞---合成的。已有研究发现GC亚群的不同功能特征,包括不同的粘液生物合成率和对细菌的反应,这表明GC群体实际上可能是异质的。
在一项新的研究中,来自瑞典哥德堡大学和美国加州大学戴维斯分校的研究人员描述了肠道GC表达的多样性,并确定了一个定位在隐窝间表面上皮(intercrypt surface epithelium)的特定GC亚群如何在功能上促进粘液屏障的形成。相关研究结果发表在2021年4月16日的Science期刊上,论文标题为“An intercrypt subpopulation of goblet cells is essential for colonic mucus barrier function”。
通过使用mCherry-MUC2转基因小鼠来分选和分离GC,这些作者生成了转录组和蛋白质组图谱来表征小肠和结肠中的GC表达景观。单细胞转录组分析揭示了每个组织区域中几个不同的GC簇,它们可分离成两个独立的轨迹。其中的一个轨迹具有已知GC特异性基因(如Clca1和Fcgbp)的富集表达,被称为典型GC。相反,另一个轨迹具有通常与肠细胞相关的基因(比如Dmbt1和Gsdmc4)的富集表达,因此被称为非典型GC。在结肠中,分化程度最高的GC是定位在隐窝之间表面上皮的高粘液周转细胞,这被称为隐窝间GC(intercrypt GC, icGC)。这些细胞的表达谱与隐窝驻留GC的表达谱不同,因此这些作者研究了它们在形成粘液屏障中的作用。他们利用粘液的凝集素结合特征来解析活组织外植体中粘液的三维结构。结果表明,icGC分泌不同的粘液,所分泌的粘液填补了从隐窝开口分泌的粘液羽(mucus plume)之间的空间区域。这种隐窝间粘液是细菌大小的珠子无法渗透的;然而,与隐窝羽粘液(crypt plume mucus)相比,它对小分子更易渗透。可渗透的表面粘液可能对离子和其他化合物的吸收很重要,而隐窝区室内更密集的粘液有助于屏蔽干细胞壁龛(stem cell niche)。
这两种粘液亚型似乎对粘液的整体保护功能很重要,因为由隐窝间粘液和隐窝羽粘液混合而成的网状组织形成了对细菌不可渗透的屏障。缺乏正常隐窝间粘液的icGC功能障碍小鼠模型表现出粘液屏障不足,更容易发生化学诱导的和自发性(年龄依赖性)的结肠炎,这证明了icGC在维持功能性粘液屏障中不可或缺的作用。此外,来自溃疡性结肠炎患者---包括那些缓解期的患者--的活组织检查结果显示GC脱落增加,icGC数量减少。这些特征与粘液屏障的结构性缺陷有关,包括隐窝间粘液的间隙。这种间隙暴露了表面上皮的区域。
7.Science:揭示PCDH19-Ncad不匹配导致女性特异性PCDH19障碍
doi:10.1126/science.aaz3893; doi:10.1126/science.abh3555
X连锁PCDH19(Protocadherin-19)基因突变可导致PCDH19障碍(PCDH19 disorder)并伴有癫痫。PCDH19障碍常伴有认知障碍和智力障碍。通常情况下,由于X连锁隐性遗传,X连锁障碍在男性身上表现出更严重的表型。相比之下,PCDH19障碍的症状表现在杂合子女性身上,而半合子男性则基本无症状。为什么会出现这种不寻常的表现尚不清楚。PCDH19编码一种单跨膜蛋白,该蛋白通过胞外钙粘蛋白结构域的同种亲合性结合(homophilic binding)介导细胞-细胞粘附。在PCDH19障碍中发现的大多数PCDH19突变改变了PCDH19蛋白胞外结构域的位点,这表明这些突变可能影响PCDH19的同种亲合性相互作用,从而影响细胞-细胞粘附。
在一项新的研究中,来自美国哈佛医学院的研究人员探究了PCDH19在大脑中的确切作用,以及女性特异性疾病表型的分子、突触和回路基础。相关研究结果发表在2021年4月16日的Science期刊上,论文标题为“Female-specific synaptic dysfunction and cognitive impairment in a mouse model of PCDH19 disorder”。

PCDH19-Ncad不匹配是女性特异性PCDH19障碍的基础。图片来自Science, 2021, doi:10.1126/science.aaz3893。
这些作者发现,Pcdh19HET♀小鼠但不是Pcdh19HEMI♂小鼠表现出苔藓纤维突触前发育的缺陷,而苔藓纤维靶向性、树突棘发育或突触后发育没有变化。Pcdh19HET♀小鼠但不是Pcdh19HEMI♂小鼠表现出神经递质释放概率降低,苔藓纤维长期电位(LTP)受损,苔藓纤维依赖性认知功能(模式完成和分离)缺陷。此外,他们发现PCDH19似乎与Ncad在苔藓纤维突触中相互作用。在Pcdh19HET♀条件下,PCDH19和Ncad之间的不匹配损害了Ncad依赖的β-连环蛋白(β-catenin)信号转导和苔藓纤维突触前发育。在Pcdh19HET♀小鼠中过表达Ncad不仅恢复了苔藓纤维突触中的β-连环蛋白簇集,而且恢复了突触功能,这表明Ncad功能受损是Pcdh19HET♀小鼠体内观察到的疾病表型的基础。
8.Science:揭示脓肿分枝杆菌的逐步致病性进化
doi:10.1126/science.abb8699; doi:10.1126/science.abi5695
目前,CF患者中超过70%的感染是由遗传上簇集(并因此传播)的分离株引起的,其中大部分来自过去50年内出现并已在全球范围内传播的三个优势循环克隆(dominant circulating clone, DCC)。这些簇集的分离株在体外和体内测试时毒性更强,并导致更糟糕的临床结果,这表明它们正在从环境腐生菌演变为专性肺部病原菌。在一项新的研究中,英国研究人员推断,对脓肿分枝杆菌的功能基因组分析可能会鉴定出这一进化轨迹中重要的可推广的步骤,并强调潜在的干预措施,以减轻这一过程对这种分枝杆菌和其他新出现的分枝杆菌病原菌的影响。相关研究结果发表在2021年4月30日的Science期刊上,论文标题为“Stepwise pathogenic evolution of Mycobacterium abscessus”。
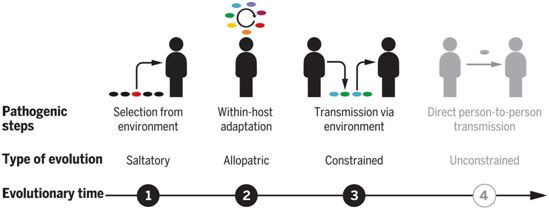
分支杆菌致病性进化的步骤,图片来自Science, 2021, doi:10.1126/science.abb8699。
接下来,这些作者研究了感染性脓肿分枝杆菌克隆的持续适应性是否能进一步促进致病性。他们重建了长期感染的患者体内单个脓肿分枝杆菌亚克隆的进化轨迹,发现个体内部和个体之间的趋同异域进化(convergent allopatric evolution)是致病性适应的关键驱动力。具体来说,来自单一功能网络的一小部分基因中的频发突变可能会驱动巨噬细胞生存能力的增强和体内毒力的增加。
这些作者观察到许多适应性突变的传播适应性降低。对于两个经常突变的基因(phoR和GPL基因座),基因敲除脓肿分枝杆菌显示出在病媒的生存能力受损。这些发现表明,宿主内部的进化受到限制,而传播需要一个环境中介。
9.Science:揭示蛋白QSER1保护DNA甲基化谷免受新生甲基化
doi:10.1126/science.abd0875; doi:10.1126/science.abh3187
DNA甲基化对哺乳动物的发育至关重要,它的失调可导致严重的病理状况,包括免疫缺陷-着丝粒不稳定-面部异常综合征(immunodeficiency-centromeric instability-facial anomalies syndrome, ICF)和小脑性侏儒症(microcephalic dwarfism)。酶DNMT和TET负责DNA甲基化的添加和去除,但它们如何协调调节甲基化景观仍然是一个核心问题。
在一项新的研究中,通过使用一种基因敲入的DNA甲基化报告基因,美国研究人员在人胚胎干细胞(hESC)中进行了全基因组CRISPR-Cas9筛选,以发现DNA甲基化调节因子。相关研究结果发表在2021年4月9日的Science期刊上,论文标题为“QSER1 protects DNA methylation valleys from de novo methylation”。
这些作者重点研究了二价启动子(bivalent promoter),其定义为同时存在激活性(H3K4me3)和抑制性(H3K27me3)组蛋白标记,并且通常由多梳抑制复合物1和2(PRC1和PRC2)占据。在干细胞或祖细胞中,二价启动子被认为将发育调节因子维持在“蓄势待发的状态”,准备在分化时激活,并且它们对在功能失调的细胞背景(比如癌症或衰老)下的DNA高度甲基化敏感。构建一种基因敲入DNA甲基化报告细胞系提供了一个可视化观察表观遗传改变的绝佳机会,否则在干细胞状态下,基因表达变化是“看不见的”。通过使用PAX6 P0二价启动子作为代表位点,这些作者旨在在具有类似染色质特征的区域发现调节DNA甲基化的机制,这不仅可以了解发育过程中的基因调控,也可以了解疾病中的表观遗传失调。
他们的筛选不仅成功地发现了已知的甲基化调节因子,如TET1、TDG和KDM2B,而且还发现了功能上未被描述的基因,包括QSER1。像TET蛋白一样,QSER1保护二价启动子和准备好的增强子(以H3K4me1为标志,但不以H3K27ac为标志)免受高度甲基化的影响。然而,与TET蛋白对调控区域的更普遍的保护作用不同,QSER1优先保护PRC2结合和H3K27me3标记的区域和DNA甲基化谷(DNA methylation valley, DMV)。
10.Science:利用新开发的intMEMOIR系统追踪细胞谱系
doi:10.1126/science.abb3099
细胞谱系在发育、稳态和疾病期间的细胞命运决定中起着关键作用。直接在细胞谱系的天然组织背景下可视化观察细胞谱系关系的能力可以对内在和外在因素在细胞命运决定中的作用提供新的见解。受从自然发生的体细胞突变中恢复谱系信息的启发,工程化谱系记录系统积极地在确定的基因组靶位点产生随机的、可遗传的突变,识别单个细胞中的这些编辑,并利用它们重建细胞谱系。然而,大多数现有的记录系统都依赖于测序来读出这些编辑,这必然会破坏组织。因此,科学家们需要一种能够准确地基于成像地在原位读出单细胞编辑历史和转录状态的记录系统。
为了解决这一挑战,美国研究人员开发出一种基于位点特异性丝氨酸整合酶(如Bxb1)的数字化、图像可读的谱系记录系统。这种称为intMEMOIR(integrase-editable memory by engineered mutagenesis with optical in situ readout)的系统引入了基于10个三态记忆元件阵列的设计。每个记忆元素都可以被数字化和不可逆地编辑,以产生理论上最多310(59049)个不同的编辑结果。这些数字状态可以使用荧光原位杂交(FISH)方法与内源性转录本一起被读出。此外,这些阵列可以在确定的基因组位点进行整合,以实现生殖系遗传性。编辑可以在不同的有机体和背景下操作,包括小鼠胚胎干细胞(mESC)和黑腹果蝇胚胎。相关研究结果发表在2021年4月9日的Science期刊上,论文标题为“Imaging cell lineage with a synthetic digital recording system”。
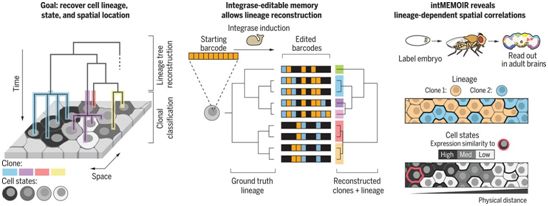
intMEMOIR支持同时分析细胞谱系、状态和空间结构。图片来自Science, 2021, doi:10.1126/science.abb3099。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


