Science:重大突破!千万不要单个拆散,不然我就投毒!我国科学家揭示CRISPR-Cas系统对宿主细胞成瘾机制
来源:本站原创 2021-04-30 06:56
2021年4月30日讯/生物谷BIOON/---CRISPR-Cas系统有效地保护细菌和古细菌免受病毒和其他类型的外来DNA的侵害,但是,作为防御系统的特征,它们也给宿主带来不可忽视的适应成本,例如,自身免疫的风险和对外源有益基因的排斥。据推测,这些代价导致CRISPR-Cas在细菌中的频繁丢失,这反映在这种系统的斑片状分布上,甚至在亲缘关系较近的细菌菌株之
2021年4月30日讯/生物谷BIOON/---CRISPR-Cas系统有效地保护细菌和古细菌免受病毒和其他类型的外来DNA的侵害,但是,作为防御系统的特征,它们也给宿主带来不可忽视的适应成本,例如,自身免疫的风险和对外源有益基因的排斥。据推测,这些代价导致CRISPR-Cas在细菌中的频繁丢失,这反映在这种系统的斑片状分布上,甚至在亲缘关系较近的细菌菌株之间。然而,在目前的基因组序列数据库中,约40%的细菌和约90%的古细菌基因组携带CRISPR-Cas位点,这表明除了适应性免疫的直接益处外,可能还存在减轻CRISPR系统的成本并防止其损失的机制。
在一项新的研究中,来自中国科学院、中国科学院大学和四川师范大学等研究机构的研究人员特别研究了一种古细菌I-B型CRISPR-Cas系统,它包括一个长311个碱基对(bp)的基因间区域,在这种系统中,编码CRISPR效应物Cascade亚基的基因不能单独剔除,但可以很容易地作为一个整体剔除。这些观察结果表明,Cascade基因盒(cas6-cas8-cas7-cas5)包括一个有毒成分,使其对宿主成瘾(一旦任何一个cascade基因被剔除就会引起细胞毒性)。相关研究结果发表在2021年4月30日的Science期刊上,论文标题为“Toxin-antitoxin RNA pairs safeguard CRISPR-Cas systems”。

这些作者克隆并广泛分析了cas6和cas8之间的这个长311bp的基因间区域,这使得他们能够确定被Cascade抑制的毒素基因creT,以及一个相关的CRISPR重复序列样序列(CRISPR repeat–like sequence),该序列似乎是抑制creT转录所需的。他们猜测该CRISPR重复序列样序列是CRISPR RNA类似抗毒素(CRISPR RNA–resembling antitoxin, CreA)RNA的一部分,它与Cascade一起共同抑制毒素基因creT。他们推断,CreTA(即creT和CreA)将使cascade基因对宿主成瘾,即让这些cascade基因不会离开宿主。
cas6和cas8之间的这个基因间序列在缺乏一个或多个cascade基因的细胞中引起毒性。通过广泛的突变分析,这些作者确定了RNA毒素基因creT及其关键序列元件,即一个强大的Shine-Dalgarno基序、一个有效的起始密码子、两个紧靠下游的小精氨酸密码子(AGA)和一个稳定的茎环结构的组合。tRNAUCU的过量表达缓解了CreT的毒性,这就支持一种机制,即这种RNA毒素通过隔绝稀少的精氨酸tRNAUCU来阻止细胞生长。
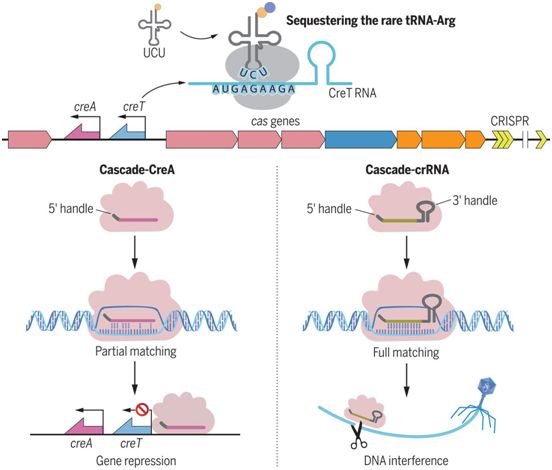
毒素-抗毒素RNA对CreTA保护CRISPR-Cas,图片来自Science, 2021, doi:10.1126/science.abe5601。
对CreT及其相邻序列的突变分析显示,相邻的CRISPR重复序列样序列是抑制CreT毒性所必需的。这个CRISPR重复序列样序列之后紧接着是一个间隔序列样序列(spacer-like sequence)和一个转录终止子。通过Northern印迹和RNA测序,这些作者证实了CreA RNA---一种缺乏3′柄的CRISPR RNA变体---的表达。CreA的间隔序列样序列与creT的启动子(PcreT)部分匹配,而且通过使用一个报告基因,他们证实当与Cascade形成复合物时,CreA抑制PcreT。与CRISPR干扰类似的是,对creT的抑制需要间隔序列邻近基序(protospacer adjacent motif, PAM)和PAM-近端碱基配对。在缺乏CreTA的细胞中,cascade基因容易受到转座因子的破坏。他们的生物信息学分析确定了多个与不同的古细菌和细菌CRISPR-cas位点相关并且含有与各自CRISPR系统相对应的PAM的CreTA类似物。值得注意的是,这些CreTA类似物在核酸序列上几乎没有保守性,这表明它们已经高度分歧地进化,因此可以想象,它们利用了不同的毒性机制。
综上所述,这些数据发现了以前没有注意到的毒素-抗毒素RNA对,它们通过使CRISPR-cas位点对宿主细胞上瘾来防止其丢失。用于基因调控的CRISPR效应物自然发生的重编程突出了CRISPR-Cas在细菌和古细菌中的多功能性,并阐明了抗病毒防御和基因调控的进化这一新兴课题。(生物谷 Bioon.com)
参考资料:
Ming Li et al. Toxin-antitoxin RNA pairs safeguard CRISPR-Cas systems. Science, 2021, doi:10.1126/science.abe5601.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


