新冠疫情:1.16亿!礼来双抗体疗法etesevimab/bamlanivimab 3期临床:治疗早期COVID-19可减少死亡/住院!
来源:本站原创 2021-03-11 19:39
etesevimab由君实生物与中科院微生物所共同开发,礼来从君实生物引进主导全球其他地区开发。
2021年03月11日讯 /生物谷BIOON/ --目前,国外新冠肺炎疫情仍在迅速蔓延。根据百度《新型冠状病毒肺炎疫情实时大数据报告》,截止2021年03月11日08时,全球累计确诊超过1亿例(1.18亿),死亡超过263万例。
近日,礼来(Eli Lilly)宣布了随机、双盲、安慰剂对照3期BLAZE-1研究的新数据,结果证实:在最近诊断为COVID-19的高危患者中,700mg剂量的bamlanivimab(LY-CoV555)和1400mg剂量的etesevimab(LY-CoV016)联合用药,显著减少了COVID-19相关的住院和死亡(“事件”)。这些结果提供了额外的疗效和安全性数据,支持了美国食品和药物管理局(FDA)最近批准的紧急使用授权(EUA)和欧洲药品管理局(EMA)人类使用药品委员会(CHMP)的积极科学意见。

这个新的3期BLAZE-1队列包括769名高危患者,年龄在12岁及以上,有轻度至中度COVID-19(药物组:n=511;安慰剂组:n=258)。数据显示,接受bamlanivimab和etesevimab治疗的患者中发生了4例事件,而接受安慰剂的患者中发生了15例事件,相当于事件风险降低87%(p<0.0001)。bamlanivimab和etesevimab在关键次要终点上也表现出统计学意义的显著改善。
这些结果与BLAZE-1研究的其他数据集中的结果一致:在之前的3期队列中,接受2800mg剂量bamlanivimab和2800mgetesevimab治疗的患者,住院和死亡的风险降低了70%;在2期队列中,仅接受bamlanivimab治疗的患者,住院和急诊的风险降低了约70%。病毒载量的降低也与之前的3期队列中观察到的结果一致。
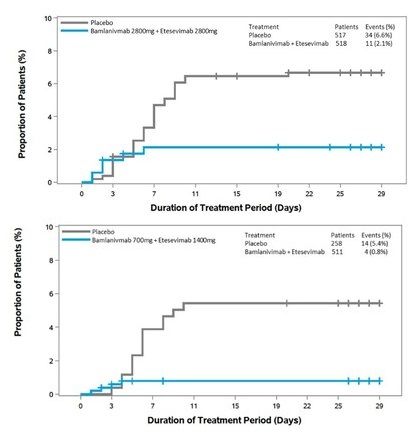
在这个新的3期队列中,共有4例死亡,所有死亡均被认为与COVID-19有关,所有死亡均发生在接受安慰剂的患者中;同时接受bamlanivimab和etesevimab治疗的患者中未发生死亡。在迄今为止分析的2个3期研究队列中,同时接受bamlanivimab和etesevimab治疗的患者没有死亡,接受安慰剂治疗的患者有14例死亡,其中13例被认为与COVID-19有关。在这个数据集中,bamlanivimab和etesevimab的安全性与评价这些抗体的其他1期、2期和3期试验的观察结果一致。
礼来首席科学官、礼来研究实验室总裁Daniel Skovronsky医学博士表示:“这些阳性结果加强了我们以前的研究结果,并支持了700mg bamlanivimab和1400mg etesevimab的授权剂量。这些令人信服的数据——除了FDA最近的EUA,EMA的CHMP决定和美国国立卫生研究院COVID-19治疗指南中的治疗建议——为医疗保健提供者提供了关于将bamlanivimab和etesevimab联合使用作为潜在的挽救生命的治疗方案的更多信息,以帮助那些最有可能发生COVID-19严重并发症的人群。几个月来,在该试验的多个队列中观察到一致的结果,即使出现了新的COVID-19变体,也表明bamlanivimab与etesevimab联合用药对一系列变体能够维持其作用,特别是美国流行的变体。”
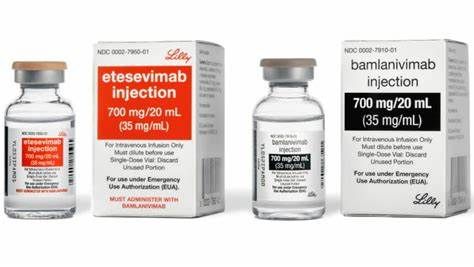
新冠肺炎(COVID-19)是由新型冠状病毒(SARS-CoV-2)引起的急性呼吸道传染病。在COVID-19疫情发生之初,君实生物与中国科学院微生物研究所(IMCAS)携手抗疫,共同开发了新冠病毒中和抗体etesevimab(JS016或LY-CoV016)。随后,礼来制药从君实生物引进了etesevimab,君实生物继续主导大中华地区的开发活动,礼来制药主导全球其他地区的开发活动。
etesevimab(JS016或LY-CoV016)是一种重组全人源单克隆中和抗体,以高亲和力特异性结合SARS-CoV-2表面刺突蛋白受体结合域,并能有效阻断病毒与宿主细胞表面受体ACE2的结合。研发团队在天然的人类IgG1抗体中引入了点突变以去除组织损伤等不良效应。一项在恒河猴中进行的新冠病毒攻毒试验结果显示,etesevimab在预防及治疗新冠病毒感染方面均具有良好疗效。
bamlanivimab(LY-CoV555)是一种针对SARS-CoV-2棘突蛋白的强效、中和性IgG1单克隆抗体。其研发旨在阻止病毒附着和进入人体细胞,从而中和病毒,潜在地预防和治疗COVID-19。bamlanivimab源自于礼来与AbCellera开发抗体疗法从而预防和治疗COVID-19的研究合作。在AbCellera发现并由国立过敏和传染病研究所(NIAID)疫苗研究中心的科学家们进行测试之后,礼来的科学家们在不到3个月的时间里迅速开发了这款抗体,该抗体是从美国第一批COVID-19康复患者身上采集的一份血液样本中鉴定出来的。
今年2月,美国FDA授予中和抗体etesevimab 1400mg和bamlanivimab 700mg双抗体疗法的紧急使用授权(EUA)。该疗法被授予用于治疗伴有进展为重度COVID-19和/或住院风险的12岁及以上轻中度COVID-19患者。患者在确诊COVID-19、并在出现症状后10天内,应该尽快通过单次静脉注射进行etesevimab和bamlanivimab双抗体治疗。
此外,FDA已批准将bamlanivimab单药以及etesevimab和bamlanivimab双抗体疗法的输注时间分别缩短至16分钟或21分钟,明显少于早前批准的60分钟时长。这一改变响应了一线负责注射给药的护士和医生的反馈,旨在减轻医疗系统负担。(生物谷Bioon.com)
原文出处:Lilly's bamlanivimab and etesevimab together reduced hospitalizations and death in Phase 3 trial for early COVID-19
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


