肺动脉高压新药!拜耳Adempas(利奥西胍) IV期研究成功:在PDE5i应答不足患者中疗效强劲!
来源:本站原创 2020-09-08 17:31
Adempas是一种sGC刺激剂,由拜耳和默沙东合作开发。

2020年09月08日讯 /生物谷BIOON/ --拜耳(Bayer)近日在2020年欧洲呼吸学会(ERS)国际会议上公布了Adempas(riociguat,利奥西胍)治疗肺动脉高压(PAH)IV期REPLACE研究的结果。结果显示,在对磷酸二酯酶5抑制剂(PDE5i)治疗反应不足的中等风险PAH成人患者(世界卫生组织[WHO]第1组)中,与继续接受PDE5i治疗相比,由PDE5i转向Adempas治疗后,有更高比例的患者(41% vs 20%)在没有临床恶化的情况下实现临床改善(复合主要终点)。
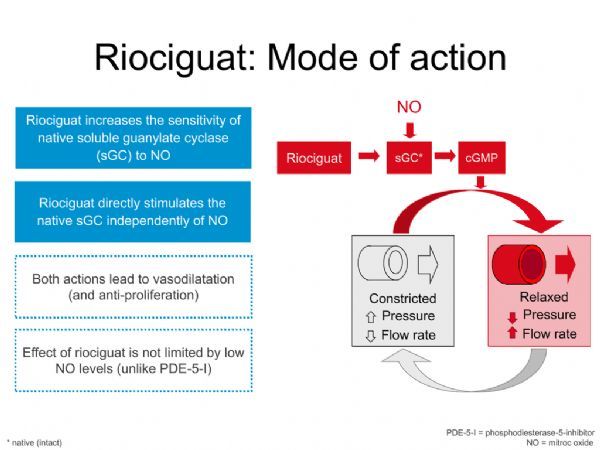
Adempas是一种首创的可溶性鸟苷酸环化酶(sGC)激动剂,能够直接刺激sGC,增强其对低水平一氧化氮(NO)的敏感度。该药是美国FDA批准用于2种类型肺高压(WHO第1组和第4组)的唯一治疗药物,可显著改善患者的运动能力。
拜耳与默沙东在sGC调节剂开展了一项全球合作,Adempas是诞生于该合作的首款sGC刺激剂,由拜耳与默沙东开发,目前已在美国、加拿大、欧盟、日本和世界其他几个国家获批上市销售。
拜耳美国医疗事务部高级医学总监、医学博士Sameer Bansilal表示:“在临床实践中,相当大比例的中度风险PAH患者在接受以PDE5i为基础的方案治疗时,不能达到或维持特定的治疗目标。REPLACE研究显示,当由PDE5过渡至Adempas治疗后,有高达41%的患者得到了满意的改善,看到这些数据非常令人高兴。除了支持治疗改进的理念外,REPLACE研究结果还补充了PATENT研究的发现,后一项研究发现,基于Adempas的单药或联合疗法可以很好地管理患者。”
REPLACE是一项前瞻性的全球、多中心、双臂、随机、对照、开放标签IV期研究,在22个国家的81个临床试验点开展。该研究在226例对磷酸二酯酶5抑制剂(PDE5i,西地那非或他达拉非)单药或联用内皮素受体拮抗剂(ERA)稳定治疗但临床反应不足的中度风险PAH患者中开展,评估了由PDE5i转向Adempas治疗、继续PDE5i治疗的疗效和安全性。中度风险PAH定义为:尽管接受了稳定剂量的PDE5i和ERA治疗,世界卫生组织功能分级(WHO FC)为III级,6分钟步行距离(6MWD)为165-440米。
该研究的复合主要终点是:治疗第24周,在没有临床恶化(任何原因导致的死亡、因PAH恶化或疾病进展而住院)情况下实现临床改善(定义为以下中的2项:6MWD较基线增加≥10%/≥30米,WHO FC I/II,NT-proBNP较基线减少≥30%)。
结果显示:在治疗第24周,与继续PDE5i治疗的患者组相比,过渡至Adempas治疗的患者组,有显著更高比例的患者达到了复合主要终点(在没有临床恶化的情况下实现临床改善:41% vs 20%;OR=2.78,95%CI:1.53-5.06;p=0.0007)。在不同类型PAH和先前疗法的患者中,反应率与总体结果一致。最常见的不良事件(AE)通常与关键性PATENT研究中观察到的一致。这些数据是拜耳与默沙东合作的一部分。
关键性PATENT-1试验是一项为期12周的多中心、双盲、随机、安慰剂对照研究,评估了Adempas在先前没有接受过治疗(初治)或接受过内皮素受体拮抗剂(ERA)或前列腺素类药物(口服、吸入、皮下)治疗(经治)的PAH成年患者(n=443)的有效性和安全性。
结果显示,与安慰剂组相比,Adempas治疗组在多个临床相关终点方面表现出改善,包括:6分钟步行距离(6MWD)36米(95%CI:20米-52米;p<0.0001)、世界卫生组织功能分级(FC;p=0.0033;大多数患者基线检查时为WHO FC II或III级)、临床恶化时间(TTCW;p=0.0046)和肺血管阻力(-226 dyn·s·cm-5;95%CI:-281至-170],p<0.001),N-末端b型利钠肽前体(NT-proBNP;-432ng/mL[95%CI:-782至-82],p<0.001)。
PATENT研究中,与安慰剂组相比,AAdempas组最常见的不良事件发生率(≥3%)是头痛(27% vs 18%)、消化不良/胃炎(21% vs 8%)、头晕(20% vs 13%)、恶心(14% vs 11%),腹泻(12% vs 8%)、低血压(10% vs 4%)、呕吐(10% vs 7%)、贫血(7% vs 2%)、胃食管反流病(5% vs 2%)和便秘(5% vs 1%)。与安慰剂组相比,Adempas组更常见的事件是心悸、鼻塞、鼻出血、吞咽困难、腹胀和周围水肿。(生物谷Bioon.com)
原文出处:Bayer Phase IV Study Met its Primary Endpoint in PAH Patients Who Had Transitioned to Adempas (riociguat) After Insufficient Response to PDE5 Inhibitors
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->