CAR-T细胞疗法研究进展(第13期)
来源:本站原创 2020-03-09 23:18
2020年3月9日讯/生物谷BIOON/---CAR-T(Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。该疗法是一种出现了很多年但近几年才被改良使用到临床中的新型细胞疗法。在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被认为是最有前景的肿瘤治疗方式之一。正如所有的技术一样,
2020年3月9日讯/生物谷BIOON/---CAR-T(Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。该疗法是一种出现了很多年但近几年才被改良使用到临床中的新型细胞疗法。在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被认为是最有前景的肿瘤治疗方式之一。正如所有的技术一样,CAR-T技术也经历一个漫长的演化过程,正是在这一系列的演化过程中,CAR-T技术逐渐走向成熟。
这种新的治疗策略的关键之处在于识别靶细胞的被称作嵌合抗原受体(chimeric antigen receptor, CAR)的人工受体,而且在经过基因修饰后,病人T细胞能够表达这种CAR。在人体临床试验中,科学家们通过一种类似透析的过程提取出病人体内的一些T细胞,然后在实验室对它们进行基因修饰,将编码这种CAR的基因导入,这样这些T细胞就能够表达这种新的受体。这些经过基因修饰的T细胞在实验室进行增殖,随后将它们灌注回病人体内。这些T细胞利用它们表达的CAR受体结合到靶细胞表面上的分子,而这种结合触发一种内部信号产生,接着这种内部信号如此强效地激活这些T细胞以至于它们快速地摧毁靶细胞。
近年来,CAR-T免疫疗法除了被用来治疗急性白血病和非霍奇金淋巴瘤之外,经改进后,也被用来治疗实体瘤、自身免疫疾病、HIV感染和心脏病等疾病,具有更广阔的应用空间。基于此,针对CAR-T细胞疗法取得的最新进展,小编进行一番盘点,以飨读者。
1.Science子刊:重大进展!重新利用蝎毒中的氯毒素,让CAR-T细胞靶向并杀死胶质母细胞瘤
doi:10.1126/scitranslmed.aaw2672
在一项新的研究中,来自美国希望之城(City of Hope)的研究人员开发并测试了首个利用氯毒素(chlorotoxin, CLTX)引导T细胞靶向脑瘤细胞的嵌合抗原受体(CAR)T细胞(CAR-T)疗法,其中氯毒素是蝎毒中的一种成分。这家研究机构还开放了首个使用这种CAR-T细胞疗法的人体临床试验。相关研究结果发表在2020年3月4日的Science Translational Medicine期刊上,论文标题为“Chlorotoxin-directed CAR T cells for specific and effective targeting of glioblastoma”。
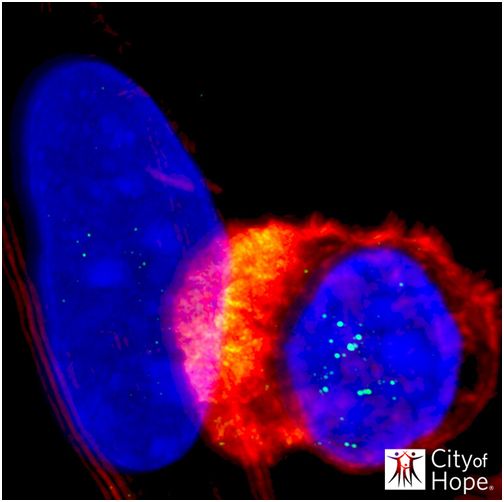
CAR通常会将单抗序列整合到它的靶向结构域中,从而使得CAR-T细胞能够识别抗原并杀死肿瘤细胞。相比之下,CLTX-CAR使用的是一种长36个氨基酸的肽序列,该序列首先从致命毒蝎的毒液中分离出来,如今经改造后作为CAR识别结构域起作用。
CLTX可结合被认为是导致肿瘤复发的GBM干细胞样细胞。与这些观察结果一致的是,CLTX-CAR-T细胞识别并杀死了大量的GBM细胞,而忽略了大脑和其他器官中的非肿瘤细胞。这些研究人员证实在细胞测定法和动物模型中,CLTX-CAR-T细胞在选择性杀死人GBM细胞方面非常有效,而且不会靶向非肿瘤细胞(off-tumor targeting),也不会导致非肿瘤毒性(off-tumor toxicity)。
论文通讯作者、希望之城的Christine Brown博士说,“整合了氯毒素的CAR扩大了CAR-T细胞疗法潜在靶向的实体瘤的数量,这对于那些难以治疗的胶质母细胞瘤等癌症患者尤其需要。这是CAR-T细胞疗法的全新靶向策略,它整合了不同于其他CAR的识别结构。”
2.Blood Adv:临床研究表明CAR-T细胞疗法可改善DLBCL患者的生活质量
doi:10.1182/bloodadvances.2019000525
一项新的研究表明用嵌合抗原受体(CAR)T细胞(CAR-T)疗法有效治疗的成年淋巴瘤患者在各种自我报告的生活质量指标上显示出明显的改善。它提供证据表明CAR-T细胞可能不仅延长癌症患者的生存期,而且还可改善治疗后的生活质量。相关研究结果发表在2020年2月11日的Blood Advances期刊上,论文标题为“Tisagenlecleucel cellular kinetics, dose, and immunogenicity in relation to clinical factors in relapsed/refractory DLBCL”。
为了确定CAR-T细胞对患者的其他益处,参与这项新研究的研究人员评估了接受称为tisagenlecleucel的CAR-T疗法治疗的复发/难治性DLBCL成人患者的生活质量。这些患者被要求使用两种工具报告其生活质量:一种工具评估身体、社会、情感和功能的健康状况,以及与疾病和治疗相关的症状,另一种工具引发与身体和社会功能、健康感知和心理健康相关的反应。在治疗前收集数据,然后在治疗后3、6、12和18个月再次收集数据,除非患者停止参与研究或者患者病情出现恶化。
在108名接受评估的患者中,有57人对tisagenlecleucel治疗获得了完全或部分缓解。患者报告的生活质量结果的基线得分在总患者人群和那些对治疗有反应的患者之间是相似的,但是有反应的患者表现出随着时间的推移生活质量的持续改善。与基线相比,对治疗有反应的患者在总体健康、活力、身体功能和社会功能方面的改善最为显著。
3.靶向TGF-β的CAR-T细胞疗法有潜力治疗实体瘤
新闻来源:Cancer immunotherapy target helps fight solid tumors
美国加州大学洛杉矶分校副教授、琼森综合癌症中心成员Yvonne Chen对诸如T细胞之类的免疫细胞进行基因改造使得它们攻击最会躲避的敌人:癌症。新的癌症免疫疗法产生的免疫细胞可以有效杀死血液癌症,但是却很难杀死实体瘤。她正在设计让免疫细胞“打败”实体瘤的方法。她于2020年2月18日在美国加州圣地亚哥市举办的第64届生物物理学会年会上介绍她的研究。
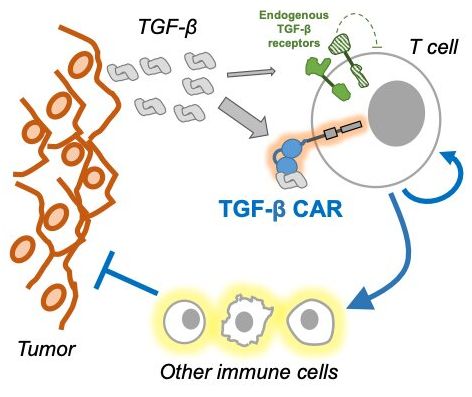
T细胞是一种白细胞,巡逻并攻击我们体内的入侵者,但它们也需要避免攻击我们自己的细胞,这是癌症能够逃避免疫系统监视的一种方式。实体瘤是在体内形成肿瘤块的癌症,占癌症病例的90%,甚至可以让免疫细胞失活。这些肿瘤可以被一种称为转化生长因子β(TGF-β)的蛋白包围。蛋白TGF-β可以抑制肿瘤环境中T细胞的活性。Chen发现了一种帮助T细胞克服TGF-β抑制来抵抗肿瘤细胞的方法。
尽管CD19 CAR-T细胞疗法已显示出令人鼓舞的临床结果,但是有时在整个治疗过程中,会出现没有CD19的癌细胞群体。Chen说,“临床试验表明,接受CD19 CAR-T细胞治疗的淋巴瘤患者中有50%会在6个月内复发,其中许多病例涉及不再表达CD19的肿瘤细胞。”为了避免这种情况,Chen设计了靶向CD19和CD20的T细胞,以降低任何癌细胞逃避治疗的可能性。这种双特异性CAR-T细胞疗法目前正在加州大学洛杉矶分校开展的I期临床试验中进行测试。
除了血液癌症以外,实体瘤一直是Chen实验室正在进行的许多研究工作的重点。 Chen说,“免疫疗法对血液肿瘤效果很好,但对实体瘤效果不佳,部分原因是TGF-β诱导的免疫抑制。”她采用经过基因改造后靶向TGF-β的CAR的新方法是针对实体瘤的良好开端。 “TGF-β CAR已显示出安全有效地增强T细胞疗法抗肿瘤功效的潜力。”
Chen和他的同事们构建出能够通过增强防御能力来对TGF-β做出反应的CAR。Chen说,“表达TGF-β反应性CAR的T细胞不是在TGF-β的作用下受到抑制,而是会做好准备在暴露于高浓度的TGF-β时遇见并攻击肿瘤细胞。” Chen及其同事们正在开发还靶向另一种肿瘤特异性标志物的TGF-β CAR-T细胞,以便开发可以有效对抗免疫抑制性实体瘤的下一代T细胞疗法。
4.Sci Adv:光调控CAR-T疗法可有效杀伤皮肤癌
doi:10.1126/sciadv.aay9209
近日,加利福尼亚大学圣地亚哥分校的生物工程师开发了一种控制系统,该系统可以使CAR T细胞疗法在治疗癌症时更安全,更有效。通过对CAR T细胞进行编程以使其在蓝光刺激下被激活,研究人员能够达到精确控制T细胞破坏小鼠皮肤肿瘤而又不损害健康组织的目的。在小鼠的测试中,接受工程化改造的CAR T细胞对皮肤肿瘤的杀伤结果显示其可使肿瘤大小减少八至九倍。而在没有外界光源刺激下时,改造的CAR T细胞本身不会抑制肿瘤的生长。该工作于2月19日发表在《Science Advance》杂志上。
文章作者,加州大学圣地亚哥分校生物工程学教授Yingxiao Wang说:“目前很难鉴定出高度特异性的实体瘤抗原分子,能够达到使CAR T细胞仅靶向这些病变的肿瘤部位而不会攻击正常器官和组织的效果。因此,CAR-T疗法迫切需要设计可在空间和时间上高精度控制的CAR T细胞。”
为了创建此类细胞,Wang和他的团队安装了一个开关,该开关可使他们在体内特定位置激活CAR T细胞。该开关使用位于CAR T细胞内部的两种工程蛋白,当暴露于蓝光脉冲时会结合。一旦结合在一起,这些蛋白质就会触发抗原靶向受体的表达。由于光线无法深入人体,Wang认为该方法可用于治疗皮肤表面附近的实体瘤。为了进行进一步的研究,Wang希望与临床医生合作以对黑素瘤患者进行测试。
5.Nat Commun:新研究表明CD229 CAR-T细胞有望治疗多发性骨髓瘤
doi:10.1038/s41467-020-14619-z
在一项新的研究中,来自美国犹他大学等研究机构的研究人员描述了一种使用嵌合抗原受体(CAR)T细胞(CAR-T)疗法治疗癌症的新方法。利用小鼠模型和来自患者的肿瘤细胞进行的实验室测试表明这种新的细胞免疫疗法在治疗多发性骨髓瘤和其他类型血液癌症中显示出有希望的结果。相关研究结果于2020年2月7日发表在Nature Communications期刊上,论文标题为“CD229 CAR T cells eliminate multiple myeloma and tumor propagating cells without fratricide”。

这些研究人员开发了靶向CD229分子的CAR-T细胞。这种分子在整个疾病过程中都存在于骨髓瘤患者的癌细胞表面上。重要的是,CD229也存在于骨髓瘤干细胞表面上,骨髓干细胞是复发患者中治疗抵抗性肿瘤细胞的来源。
这项研究是由犹他大学血液学与血液系统恶性肿瘤科内科副教授Djordje Atanackovic博士领导。这项研究基于Atanackovic和他的同事们的早期研究工作:他们已鉴定出CD229存在于多发性骨髓瘤细胞和其他B细胞癌细胞表面上。一旦鉴定出靶标CD229,他们就花费数年的时间来完成复杂的实验室工作,以测试CD229是否是一种可行的CAR-T细胞疗法的新靶标。
犹他大学细胞与蛋白工程专家Tim Luetkens博士和犹他大学内科助理教授Sabarinath Radhakrishnan博士在Atanackovic实验室中领导了这种疗法的开发。他们设计出首个针对CD229的全人抗体,并且利用这种设计出的抗体,构建出靶向CD229的CAR-T细胞。他们在小鼠模型和来自骨髓瘤患者的癌症干细胞中证实CD229 CAR-T细胞杀死成熟的多发性骨髓瘤细胞和骨髓瘤干细胞。他们还发现在这种实验室条件中,经过CD229 CAR-T细胞治疗的骨髓瘤似乎产生持久的免疫反应。
6.Nat Biotechnol:新方法促进CAR-T细胞在实体瘤中存活和增殖
doi:10.1038/s41587-019-0398-2
肿瘤会为抵抗癌症的免疫细胞(比如T细胞)创造一个不利的环境。在一项新的研究中,来自美国北卡罗来纳大学教堂山分校和中国西安交通大学的研究人员对免疫细胞进行基因改造而改善它们的存活和增殖,即便在不友善的肿瘤中也是如此。相关研究结果于2020年2月3日在线发表在Nature Biotechnology期刊上,论文标题为“Interleukin-23 engineering improves CAR T cell function in solid tumors”。
论文共同通讯作者、北卡罗来纳大学教堂山分校莱恩伯格综合癌症中心的Gianpietro Dotti博士及其研究团队开发出一种方法来提供刺激信号,使得寻找癌症的免疫细胞---嵌合抗原受体(CAR)T细胞(CAR-T),它们经过基因改造而能够寻找和杀死特定的癌症---超负荷运转,简言之,利用一种刺激信号激活CAR-T细胞。他们的临床前发现提供了一种新的方法来让这些经过基因改造的T细胞增殖,同时避免激活可能引起脱靶副作用的其他免疫细胞。
这些研究人员发现了有关刺激分子IL-23功能的重要见解。他们确定这种刺激分子的受体仅在抵抗癌症的T细胞被激活时才会出现。基于这一发现,他们想知道他们是否可以对T细胞进行基因改造使得它们自我产生这种增殖信号,而且仅在抵抗肿瘤的T细胞中自我产生。这他们随后报道了一种对这些T细胞进行基因改造以产生IL-23的方法。更具体地说,他们对这些T细胞进行了基因改造,使得当它们识别出肿瘤并被刺激而杀死肿瘤时,它们也会被刺激而产生IL-23,从而帮助它们增殖。
这些研究人员在神经母细胞瘤和胰腺癌的小鼠模型中证实了他们的这种增加CAR-T细胞增殖的方法。他们正计划继续开展他们的研究工作,以发现以其他方式改进这些经过基因改造的T细胞的功能,比如增强它们的代谢活性,使得它们能够在营养不足的肿瘤中更好地发挥功能。
7.NEJM:临床试验表明CD19 CAR-NK细胞疗法在白血病和淋巴瘤患者中实现73%的缓解率
doi:10.1056/NEJMoa1910607
在一项新的I/IIa期临床试验中,来自美国德克萨斯大学MD安德森癌症中心的研究人员报道利用脐带血来源的靶向CD19的嵌合抗原受体(CAR)自然杀伤细胞(CAR-NK)进行治疗可导致大多数患有复发性或难治性非霍奇金淋巴瘤(NHL)和慢性淋巴细胞白血病(CLL)患者出现临床反应,而且未观察到主要的毒副作用。相关研究结果发表在2020年2月6日的NEJM期刊上,论文标题为“Use of CAR-Transduced Natural Killer Cells in CD19-Positive Lymphoid Tumors”。
在参与这项临床研究的11名患者中,8人(73%)对治疗作出反应,其中7人完全缓解,这意味着他们在中位随访13.8个月时不再显示疾病迹象。缓解后的治疗是对其中的5名有反应的患者进行的。没有患者经历细胞因子释放综合征和神经毒性。在输注后1个月内对CD19 CAR-NK细胞疗法的反应明显,并且在输注后1年内证实了这些细胞的持久存在。
论文通讯作者、德克萨斯大学MD安德森癌症中心干细胞移植与细胞治疗教授Katayoun Rezvani博士说,“这项临床试验的结果令我们备感鼓舞,我们将开展进一步的临床试验,以研究脐血来源的同种异体CAR-NK细胞作为有需要的患者的潜在治疗选择。”
8.Nature热评:CRISPR正推动CAR-T细胞快速前进
doi:10.1038/d42473-019-00443-7
在过去的十年里,一种新的免疫治疗工具进入了临床。被设计成表达嵌合抗原受体的T细胞,即CAR-T细胞,已经被证明可以帮助血癌患者。2011年的一项关键研究使用第二代CAR-T细胞来实现大多数测试患者T细胞的持续激活和缓解。一年后出现了另一个重大突破,两个小组描述了一种名为CRISPR-Cas9的新型基因编辑工具,并演示了它在真核细胞中的应用。这两份报告帮助开启了基因编辑的新时代。尽管基因编辑有可能改善细胞工程,但CAR-T细胞和CRISPR的交叉还需要几年时间。
从一开始,CRISPR就像是制造T细胞的理想方法。这是一个简单的过程,具有最小的脱靶效应,适用于多种细胞类型。但CRISPR在一个领域遇到了困难。CRISPR-Cas9通过产生靶向双链DNA (dsDNA)断裂,然后通过细胞的非同源末端连接途径修复,从而有效地产生小的突变。然而,当使用同源导向的修复机制插入外源DNA时,CRISPR编辑的效率可能低得可怜。然而,插入DNA对于制造CAR-T细胞至关重要。
去年,Alexander Marson、Gurumurthy和他的同事们利用Easi-CRISPR对人类T细胞的结构和功能进行了重新编程,且不需要病毒载体。本研究表明,将ssDNA作为同源性导向的修复模板对T细胞进行CRISPR编辑,与dsDNA模板相比,能够更准确、更有效地进行大规模的基因插入,并且脱靶整合概率更低。
虽然有希望,但还有一个重要的考虑:长ssDNA序列很难在实验室中产生,尤其是在基因编辑实验中需要高浓度的长ssDNA。一些公司和研究开发人员正试图解决这个问题,他们正在研究有效生成大量长ssDNA的方法。总部位于新泽西州皮斯卡塔韦(Piscataway)的全球生物技术公司GenScript以其领先的DNA合成技术而闻名。该公司最近开始提供数千个核苷酸长度的ssDNA,数量可达100微克--这是使用CRISPR进行T细胞重编程的理想选择。GenScript也是为数不多的提供完整的CRISPR解决方案的公司之一,包括HPLC纯化的、化学合成的sgRNAs,并通过末端修饰来增强CRISPR编辑。
基因编辑正在改变研究人员研究细胞工程的方式。像Easi-CRISPR这样的方法,连同DNA和RNA合成的改进,将进一步加强CAR-T细胞工程的努力,最终改善癌症治疗和人类健康。(生物谷 Bioon.com)
这种新的治疗策略的关键之处在于识别靶细胞的被称作嵌合抗原受体(chimeric antigen receptor, CAR)的人工受体,而且在经过基因修饰后,病人T细胞能够表达这种CAR。在人体临床试验中,科学家们通过一种类似透析的过程提取出病人体内的一些T细胞,然后在实验室对它们进行基因修饰,将编码这种CAR的基因导入,这样这些T细胞就能够表达这种新的受体。这些经过基因修饰的T细胞在实验室进行增殖,随后将它们灌注回病人体内。这些T细胞利用它们表达的CAR受体结合到靶细胞表面上的分子,而这种结合触发一种内部信号产生,接着这种内部信号如此强效地激活这些T细胞以至于它们快速地摧毁靶细胞。
近年来,CAR-T免疫疗法除了被用来治疗急性白血病和非霍奇金淋巴瘤之外,经改进后,也被用来治疗实体瘤、自身免疫疾病、HIV感染和心脏病等疾病,具有更广阔的应用空间。基于此,针对CAR-T细胞疗法取得的最新进展,小编进行一番盘点,以飨读者。
1.Science子刊:重大进展!重新利用蝎毒中的氯毒素,让CAR-T细胞靶向并杀死胶质母细胞瘤
doi:10.1126/scitranslmed.aaw2672
在一项新的研究中,来自美国希望之城(City of Hope)的研究人员开发并测试了首个利用氯毒素(chlorotoxin, CLTX)引导T细胞靶向脑瘤细胞的嵌合抗原受体(CAR)T细胞(CAR-T)疗法,其中氯毒素是蝎毒中的一种成分。这家研究机构还开放了首个使用这种CAR-T细胞疗法的人体临床试验。相关研究结果发表在2020年3月4日的Science Translational Medicine期刊上,论文标题为“Chlorotoxin-directed CAR T cells for specific and effective targeting of glioblastoma”。

蓝色表示细胞核(较大:肿瘤细胞;较小:T细胞)。黄色聚集于这两个细胞之间的界面上,代表着免疫突触的形成,免疫突触是T细胞活化的一个关键指标。T细胞经活化后将会杀死肿瘤。图片来自City of Hope。
CAR通常会将单抗序列整合到它的靶向结构域中,从而使得CAR-T细胞能够识别抗原并杀死肿瘤细胞。相比之下,CLTX-CAR使用的是一种长36个氨基酸的肽序列,该序列首先从致命毒蝎的毒液中分离出来,如今经改造后作为CAR识别结构域起作用。
CLTX可结合被认为是导致肿瘤复发的GBM干细胞样细胞。与这些观察结果一致的是,CLTX-CAR-T细胞识别并杀死了大量的GBM细胞,而忽略了大脑和其他器官中的非肿瘤细胞。这些研究人员证实在细胞测定法和动物模型中,CLTX-CAR-T细胞在选择性杀死人GBM细胞方面非常有效,而且不会靶向非肿瘤细胞(off-tumor targeting),也不会导致非肿瘤毒性(off-tumor toxicity)。
论文通讯作者、希望之城的Christine Brown博士说,“整合了氯毒素的CAR扩大了CAR-T细胞疗法潜在靶向的实体瘤的数量,这对于那些难以治疗的胶质母细胞瘤等癌症患者尤其需要。这是CAR-T细胞疗法的全新靶向策略,它整合了不同于其他CAR的识别结构。”
2.Blood Adv:临床研究表明CAR-T细胞疗法可改善DLBCL患者的生活质量
doi:10.1182/bloodadvances.2019000525
一项新的研究表明用嵌合抗原受体(CAR)T细胞(CAR-T)疗法有效治疗的成年淋巴瘤患者在各种自我报告的生活质量指标上显示出明显的改善。它提供证据表明CAR-T细胞可能不仅延长癌症患者的生存期,而且还可改善治疗后的生活质量。相关研究结果发表在2020年2月11日的Blood Advances期刊上,论文标题为“Tisagenlecleucel cellular kinetics, dose, and immunogenicity in relation to clinical factors in relapsed/refractory DLBCL”。
为了确定CAR-T细胞对患者的其他益处,参与这项新研究的研究人员评估了接受称为tisagenlecleucel的CAR-T疗法治疗的复发/难治性DLBCL成人患者的生活质量。这些患者被要求使用两种工具报告其生活质量:一种工具评估身体、社会、情感和功能的健康状况,以及与疾病和治疗相关的症状,另一种工具引发与身体和社会功能、健康感知和心理健康相关的反应。在治疗前收集数据,然后在治疗后3、6、12和18个月再次收集数据,除非患者停止参与研究或者患者病情出现恶化。
在108名接受评估的患者中,有57人对tisagenlecleucel治疗获得了完全或部分缓解。患者报告的生活质量结果的基线得分在总患者人群和那些对治疗有反应的患者之间是相似的,但是有反应的患者表现出随着时间的推移生活质量的持续改善。与基线相比,对治疗有反应的患者在总体健康、活力、身体功能和社会功能方面的改善最为显著。
3.靶向TGF-β的CAR-T细胞疗法有潜力治疗实体瘤
新闻来源:Cancer immunotherapy target helps fight solid tumors
美国加州大学洛杉矶分校副教授、琼森综合癌症中心成员Yvonne Chen对诸如T细胞之类的免疫细胞进行基因改造使得它们攻击最会躲避的敌人:癌症。新的癌症免疫疗法产生的免疫细胞可以有效杀死血液癌症,但是却很难杀死实体瘤。她正在设计让免疫细胞“打败”实体瘤的方法。她于2020年2月18日在美国加州圣地亚哥市举办的第64届生物物理学会年会上介绍她的研究。

实体瘤被TGF-β包围着,从而抑制肿瘤环境中T细胞的活性。然而,T细胞经基因改造后可抵抗这种抑制,而且经激活后可抵抗肿瘤。图片来自ZeNan Chang。
T细胞是一种白细胞,巡逻并攻击我们体内的入侵者,但它们也需要避免攻击我们自己的细胞,这是癌症能够逃避免疫系统监视的一种方式。实体瘤是在体内形成肿瘤块的癌症,占癌症病例的90%,甚至可以让免疫细胞失活。这些肿瘤可以被一种称为转化生长因子β(TGF-β)的蛋白包围。蛋白TGF-β可以抑制肿瘤环境中T细胞的活性。Chen发现了一种帮助T细胞克服TGF-β抑制来抵抗肿瘤细胞的方法。
尽管CD19 CAR-T细胞疗法已显示出令人鼓舞的临床结果,但是有时在整个治疗过程中,会出现没有CD19的癌细胞群体。Chen说,“临床试验表明,接受CD19 CAR-T细胞治疗的淋巴瘤患者中有50%会在6个月内复发,其中许多病例涉及不再表达CD19的肿瘤细胞。”为了避免这种情况,Chen设计了靶向CD19和CD20的T细胞,以降低任何癌细胞逃避治疗的可能性。这种双特异性CAR-T细胞疗法目前正在加州大学洛杉矶分校开展的I期临床试验中进行测试。
除了血液癌症以外,实体瘤一直是Chen实验室正在进行的许多研究工作的重点。 Chen说,“免疫疗法对血液肿瘤效果很好,但对实体瘤效果不佳,部分原因是TGF-β诱导的免疫抑制。”她采用经过基因改造后靶向TGF-β的CAR的新方法是针对实体瘤的良好开端。 “TGF-β CAR已显示出安全有效地增强T细胞疗法抗肿瘤功效的潜力。”
Chen和他的同事们构建出能够通过增强防御能力来对TGF-β做出反应的CAR。Chen说,“表达TGF-β反应性CAR的T细胞不是在TGF-β的作用下受到抑制,而是会做好准备在暴露于高浓度的TGF-β时遇见并攻击肿瘤细胞。” Chen及其同事们正在开发还靶向另一种肿瘤特异性标志物的TGF-β CAR-T细胞,以便开发可以有效对抗免疫抑制性实体瘤的下一代T细胞疗法。
4.Sci Adv:光调控CAR-T疗法可有效杀伤皮肤癌
doi:10.1126/sciadv.aay9209
近日,加利福尼亚大学圣地亚哥分校的生物工程师开发了一种控制系统,该系统可以使CAR T细胞疗法在治疗癌症时更安全,更有效。通过对CAR T细胞进行编程以使其在蓝光刺激下被激活,研究人员能够达到精确控制T细胞破坏小鼠皮肤肿瘤而又不损害健康组织的目的。在小鼠的测试中,接受工程化改造的CAR T细胞对皮肤肿瘤的杀伤结果显示其可使肿瘤大小减少八至九倍。而在没有外界光源刺激下时,改造的CAR T细胞本身不会抑制肿瘤的生长。该工作于2月19日发表在《Science Advance》杂志上。
文章作者,加州大学圣地亚哥分校生物工程学教授Yingxiao Wang说:“目前很难鉴定出高度特异性的实体瘤抗原分子,能够达到使CAR T细胞仅靶向这些病变的肿瘤部位而不会攻击正常器官和组织的效果。因此,CAR-T疗法迫切需要设计可在空间和时间上高精度控制的CAR T细胞。”
为了创建此类细胞,Wang和他的团队安装了一个开关,该开关可使他们在体内特定位置激活CAR T细胞。该开关使用位于CAR T细胞内部的两种工程蛋白,当暴露于蓝光脉冲时会结合。一旦结合在一起,这些蛋白质就会触发抗原靶向受体的表达。由于光线无法深入人体,Wang认为该方法可用于治疗皮肤表面附近的实体瘤。为了进行进一步的研究,Wang希望与临床医生合作以对黑素瘤患者进行测试。
5.Nat Commun:新研究表明CD229 CAR-T细胞有望治疗多发性骨髓瘤
doi:10.1038/s41467-020-14619-z
在一项新的研究中,来自美国犹他大学等研究机构的研究人员描述了一种使用嵌合抗原受体(CAR)T细胞(CAR-T)疗法治疗癌症的新方法。利用小鼠模型和来自患者的肿瘤细胞进行的实验室测试表明这种新的细胞免疫疗法在治疗多发性骨髓瘤和其他类型血液癌症中显示出有希望的结果。相关研究结果于2020年2月7日发表在Nature Communications期刊上,论文标题为“CD229 CAR T cells eliminate multiple myeloma and tumor propagating cells without fratricide”。

与多发性骨髓瘤存在组织学上相关性的浆细胞瘤的显微图,图片来自Wikipedia/CC BY-SA 3.0。
这些研究人员开发了靶向CD229分子的CAR-T细胞。这种分子在整个疾病过程中都存在于骨髓瘤患者的癌细胞表面上。重要的是,CD229也存在于骨髓瘤干细胞表面上,骨髓干细胞是复发患者中治疗抵抗性肿瘤细胞的来源。
这项研究是由犹他大学血液学与血液系统恶性肿瘤科内科副教授Djordje Atanackovic博士领导。这项研究基于Atanackovic和他的同事们的早期研究工作:他们已鉴定出CD229存在于多发性骨髓瘤细胞和其他B细胞癌细胞表面上。一旦鉴定出靶标CD229,他们就花费数年的时间来完成复杂的实验室工作,以测试CD229是否是一种可行的CAR-T细胞疗法的新靶标。
犹他大学细胞与蛋白工程专家Tim Luetkens博士和犹他大学内科助理教授Sabarinath Radhakrishnan博士在Atanackovic实验室中领导了这种疗法的开发。他们设计出首个针对CD229的全人抗体,并且利用这种设计出的抗体,构建出靶向CD229的CAR-T细胞。他们在小鼠模型和来自骨髓瘤患者的癌症干细胞中证实CD229 CAR-T细胞杀死成熟的多发性骨髓瘤细胞和骨髓瘤干细胞。他们还发现在这种实验室条件中,经过CD229 CAR-T细胞治疗的骨髓瘤似乎产生持久的免疫反应。
6.Nat Biotechnol:新方法促进CAR-T细胞在实体瘤中存活和增殖
doi:10.1038/s41587-019-0398-2
肿瘤会为抵抗癌症的免疫细胞(比如T细胞)创造一个不利的环境。在一项新的研究中,来自美国北卡罗来纳大学教堂山分校和中国西安交通大学的研究人员对免疫细胞进行基因改造而改善它们的存活和增殖,即便在不友善的肿瘤中也是如此。相关研究结果于2020年2月3日在线发表在Nature Biotechnology期刊上,论文标题为“Interleukin-23 engineering improves CAR T cell function in solid tumors”。
论文共同通讯作者、北卡罗来纳大学教堂山分校莱恩伯格综合癌症中心的Gianpietro Dotti博士及其研究团队开发出一种方法来提供刺激信号,使得寻找癌症的免疫细胞---嵌合抗原受体(CAR)T细胞(CAR-T),它们经过基因改造而能够寻找和杀死特定的癌症---超负荷运转,简言之,利用一种刺激信号激活CAR-T细胞。他们的临床前发现提供了一种新的方法来让这些经过基因改造的T细胞增殖,同时避免激活可能引起脱靶副作用的其他免疫细胞。
这些研究人员发现了有关刺激分子IL-23功能的重要见解。他们确定这种刺激分子的受体仅在抵抗癌症的T细胞被激活时才会出现。基于这一发现,他们想知道他们是否可以对T细胞进行基因改造使得它们自我产生这种增殖信号,而且仅在抵抗肿瘤的T细胞中自我产生。这他们随后报道了一种对这些T细胞进行基因改造以产生IL-23的方法。更具体地说,他们对这些T细胞进行了基因改造,使得当它们识别出肿瘤并被刺激而杀死肿瘤时,它们也会被刺激而产生IL-23,从而帮助它们增殖。
这些研究人员在神经母细胞瘤和胰腺癌的小鼠模型中证实了他们的这种增加CAR-T细胞增殖的方法。他们正计划继续开展他们的研究工作,以发现以其他方式改进这些经过基因改造的T细胞的功能,比如增强它们的代谢活性,使得它们能够在营养不足的肿瘤中更好地发挥功能。
7.NEJM:临床试验表明CD19 CAR-NK细胞疗法在白血病和淋巴瘤患者中实现73%的缓解率
doi:10.1056/NEJMoa1910607
在一项新的I/IIa期临床试验中,来自美国德克萨斯大学MD安德森癌症中心的研究人员报道利用脐带血来源的靶向CD19的嵌合抗原受体(CAR)自然杀伤细胞(CAR-NK)进行治疗可导致大多数患有复发性或难治性非霍奇金淋巴瘤(NHL)和慢性淋巴细胞白血病(CLL)患者出现临床反应,而且未观察到主要的毒副作用。相关研究结果发表在2020年2月6日的NEJM期刊上,论文标题为“Use of CAR-Transduced Natural Killer Cells in CD19-Positive Lymphoid Tumors”。

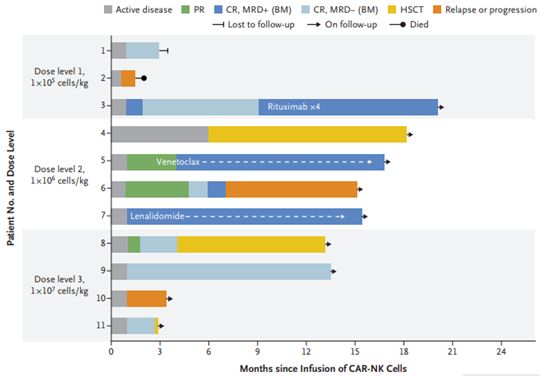
图片来自NEJM, 2020, doi:10.1056/NEJMoa1910607。
在参与这项临床研究的11名患者中,8人(73%)对治疗作出反应,其中7人完全缓解,这意味着他们在中位随访13.8个月时不再显示疾病迹象。缓解后的治疗是对其中的5名有反应的患者进行的。没有患者经历细胞因子释放综合征和神经毒性。在输注后1个月内对CD19 CAR-NK细胞疗法的反应明显,并且在输注后1年内证实了这些细胞的持久存在。
论文通讯作者、德克萨斯大学MD安德森癌症中心干细胞移植与细胞治疗教授Katayoun Rezvani博士说,“这项临床试验的结果令我们备感鼓舞,我们将开展进一步的临床试验,以研究脐血来源的同种异体CAR-NK细胞作为有需要的患者的潜在治疗选择。”
8.Nature热评:CRISPR正推动CAR-T细胞快速前进
doi:10.1038/d42473-019-00443-7
在过去的十年里,一种新的免疫治疗工具进入了临床。被设计成表达嵌合抗原受体的T细胞,即CAR-T细胞,已经被证明可以帮助血癌患者。2011年的一项关键研究使用第二代CAR-T细胞来实现大多数测试患者T细胞的持续激活和缓解。一年后出现了另一个重大突破,两个小组描述了一种名为CRISPR-Cas9的新型基因编辑工具,并演示了它在真核细胞中的应用。这两份报告帮助开启了基因编辑的新时代。尽管基因编辑有可能改善细胞工程,但CAR-T细胞和CRISPR的交叉还需要几年时间。
从一开始,CRISPR就像是制造T细胞的理想方法。这是一个简单的过程,具有最小的脱靶效应,适用于多种细胞类型。但CRISPR在一个领域遇到了困难。CRISPR-Cas9通过产生靶向双链DNA (dsDNA)断裂,然后通过细胞的非同源末端连接途径修复,从而有效地产生小的突变。然而,当使用同源导向的修复机制插入外源DNA时,CRISPR编辑的效率可能低得可怜。然而,插入DNA对于制造CAR-T细胞至关重要。
去年,Alexander Marson、Gurumurthy和他的同事们利用Easi-CRISPR对人类T细胞的结构和功能进行了重新编程,且不需要病毒载体。本研究表明,将ssDNA作为同源性导向的修复模板对T细胞进行CRISPR编辑,与dsDNA模板相比,能够更准确、更有效地进行大规模的基因插入,并且脱靶整合概率更低。
虽然有希望,但还有一个重要的考虑:长ssDNA序列很难在实验室中产生,尤其是在基因编辑实验中需要高浓度的长ssDNA。一些公司和研究开发人员正试图解决这个问题,他们正在研究有效生成大量长ssDNA的方法。总部位于新泽西州皮斯卡塔韦(Piscataway)的全球生物技术公司GenScript以其领先的DNA合成技术而闻名。该公司最近开始提供数千个核苷酸长度的ssDNA,数量可达100微克--这是使用CRISPR进行T细胞重编程的理想选择。GenScript也是为数不多的提供完整的CRISPR解决方案的公司之一,包括HPLC纯化的、化学合成的sgRNAs,并通过末端修饰来增强CRISPR编辑。
基因编辑正在改变研究人员研究细胞工程的方式。像Easi-CRISPR这样的方法,连同DNA和RNA合成的改进,将进一步加强CAR-T细胞工程的努力,最终改善癌症治疗和人类健康。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


