深度解读人类微生物组研究的25个重大里程碑事件!
来源:本站原创 2019-07-20 13:19
图片来源:Tetra Images/Alamy Stock Photo诞生尽管人类微生物群落被认为是一个相对现代的研究领域,然而对该领域的首次描述还要追溯到17世纪70年代至17世纪80年代,当时研究者安东尼-范-列文虎克(Antonie van Leeuwenhoek)刚开始使用他新开发的手工显微镜。自从17世纪研究者列文虎克第一次开始研究微生物以来,与人类相关的微生物的研究已经取得了长足的进展

图片来源:Tetra Images/Alamy Stock Photo
诞生
尽管人类微生物群落被认为是一个相对现代的研究领域,然而对该领域的首次描述还要追溯到17世纪70年代至17世纪80年代,当时研究者安东尼-范-列文虎克(Antonie van Leeuwenhoek)刚开始使用他新开发的手工显微镜。自从17世纪研究者列文虎克第一次开始研究微生物以来,与人类相关的微生物的研究已经取得了长足的进展。
图片来源:S. Fenwick/Springer Nature Limited
里程碑1—1944年
培养厌氧菌
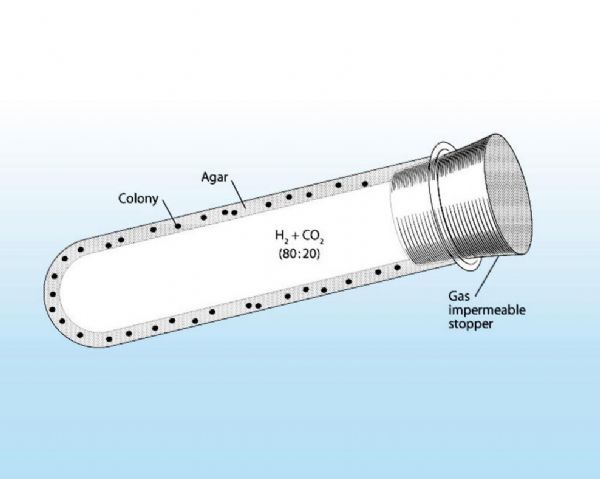
1944年,在对牛瘤胃中降解纤维素的微生物进行研究时,研究者Robert. E. Hungate利用其开发的旋转管的方法(roll-tube approach)使得厌氧菌的培养成为了可能,这种一直沿用到今天的方法也帮助科学家们首次分离到了与人类相关的厌氧菌。
里程碑2—1958年
粪便微生物移植用于治疗艰难梭菌感染
1958年,在一项研究中,研究人员利用粪便灌肠(faecal enema)的方法成功治疗了假膜性小肠结肠炎(pseudomembranous enterocolitis),从那时候开始,粪便微生物移植的方法(faecal microbiota transplantation)就因能够成功治疗复发性艰难梭菌感染而被科学家们广泛接受。
里程碑3—1965年
在无菌动物中进行肠道微生物转移实验
1965年,在研究领域无菌动物有了一个新的用途,即研究人员将细菌培养物转移到无菌小鼠机体中,诸如这样的转移性实验对于研究肠道微生物对宿主的健康效应至关重要。
里程碑4—1972年
微生物影响宿主定向药物的代谢过程
研究者Peppercorn和Goldman通过研究发现,当与人类肠道菌群一起进行培养时,抗炎性药物柳氮磺胺吡啶(salicylazosulfapyridine)或许能在一般的大鼠体内进行降解,但在无菌大鼠体内并不会发生,这就阐明了肠道微生物群落在药物转换过程中扮演的关键角色。如今越来越多的研究都证实,微生物群落(并不仅限于肠道)在宿主机体药物代谢中扮演着关键的角色,同时这也强调了其对药物失活、疗效和毒性方面的影响[1]。
里程碑5—1981年
早期生命中微生物的演替
早在1900年就有研究描述了婴儿机体中细菌演替的多个方面,但到1981年,在三项研究中,研究人员开始研究定量分析肠道菌群早期的一些特征,同时研究者还分析了喂养方式对塑造机体早期微生物群落的影响和机制。

图片来源:Sean Prior/Alamy Stock Photo
里程碑6—1996年
基于测序对人类相关微生物群落进行鉴别
1996年,研究人员开始利用基于测序的方法对人类相关的微生物群落进行鉴别,研究人员利用16S核糖体RNA测序方法分析了人类粪便样本中能够进行培养和无法进行培养的细菌的多样性及其特征。
里程碑7—1998年
成年人机体中微生物群落的稳定性和个性
1998年,研究人员使用16S核糖体RNA基因扩增技术和温度梯度凝胶电泳(TGGE)技术观察16名成年人粪便中细菌的多样性,结果表明,每个人机体中都有其独特的微生物群落;随后通过对两名参与者进行长期监测,研究人员发现,这两名参与者TGGE的特性在至少6个月的时间里都处于稳定状态,在随后的研究中,研究人员调查了在较长的时间里参与者机体微生物群落的稳定性。
里程碑8—2003年
除了细菌外,开始对其它宿主相关的微生物进行研究
病毒、真菌和古细菌是人类机体微生物群落的重要成员,其对人类健康有着潜在的影响;2003年,研究人员首次对人类粪便中无法培养的病毒群落进行了宏基因组学分析。
里程碑9—2004年
通过微生物群落调节机体的粘膜免疫
两项研究揭示了机体免疫系统感知微生物群落的机制,同时还阐明了细菌如何在正常条件下调节机体免疫系统的发育和功能;相关研究为我们认识机体对微生物的免疫反应开启了另外一个视角,其并不是作为宿主防御,而是作为一种共生的生理学过程。
里程碑10—2005年
充分“喂养”机体微生物群落的重要性
拥有成千上万个基因的肠道微生物组能够帮助参与分解食物,并从中获取能量,2005年的一项研究表明,个体饮食的改变或能改变机体结肠中微生物群落的降解活性。

图片来源:Gl0ck/Alamy Stock Photo
里程碑11—2006年
通过微生物移植来转移宿主的表型
研究人员发现,通过粪便微生物移植就能够在小鼠机体中再现人类的表型,这项首次使用肥胖和瘦弱人群粪便进行的研究为后期研究人员调查机体微生物群落与人类机体表型之间的关联奠定了坚实的基础。
里程碑12—2006年
饮食-微生物之间的相互作用对人类机体代谢的影响
从2006年开始,大量研究都表明饮食对机体肠道微生物群落和宿主的代谢有着非常重要的影响,相关研究结果对于研究人类健康也具有重要意义;同时科学家们还有望利用饮食与微生物群落之间的相互作用来开发基于营养的新型疗法。
里程碑13—2007年
定植抗性的机制
在早期研究中,研究人员已经观察到了“定植抗性”(colonization resistance)这种现象,定植抗性,即机体微生物群落阻断病原体在机体建立感染的过程;然而2007年三篇重要的研究报告对这一过程发生背后的分子机制进行了初步的探讨。
里程碑14—2007年
在体内利用组学技术对人类功能微生物群落进行分析
研究者Eline Klaassens及其同事应用宏蛋白质组的方法对无法培养的粪便微生物群落进行研究,提供了微生物群落分类鉴定之外的一种新的见解;随后研究人员利用诸如代谢组学、元转录组学等组学方法进行了大量研究,同时研究者还开发出了多组学管线,这些方法至今还能够用来分析微生物群落的功能[2]。
里程碑15—2010年
抗生素对微生物群落的组成和宿主健康的影响效应
抗生素不仅会对引发机体感染的细菌发挥作用,其还会影响宿主自身的微生物群落的健康,2008年,有研究就表明,利用环丙沙星对健康个体进行治疗或会影响其粪便样本中大约三分之一的细菌丰度。
图片来源:N. Smith/Springer Nature Limited
里程碑16—2010年
生物信息学工具能够帮助分析微生物组的测序数据
名为QIIME(微生物生态学定量研究,quantitative insights into microbial ecology)的工具能够对微生物组测序所产生的大量数据进行分析并解释[3]。
里程碑17—2011年
对大规模人群进行微生物组分析
21世纪初期,随着宏基因组和高通量测序技术的进展,科学家们开始利用这些技术来进行大规模人群机体微生物组多样性的研究,而且大规模的人群研究也能够改善我们对机体微生物组多样性的理解,同时还能够发现这些微生物与人类健康及疾病之间的潜在关联。
里程碑18—2012年
微生物—肠—脑轴
2011年,研究人员对小鼠进行的多项研究阐明了机体缺少常规微生物对机体行为、大脑中基因表达和神经系统发育的影响机制,而最近对人类进行的多项研究也揭示了机体微生物群落与机体神经系统之间的潜在关联。
里程碑19—2012年
现代培养技术或能扩大可培养的微生物群落的种类
高通量厌氧培养技术或能帮助培养出大部分人类肠道微生物,同时研究者还能够实现对单一微生物进行培养[4]。
里程碑20—2012年
全球人类微生物组
居住在不同地方的人群机体之间存在一定的遗传变异,但研究人员并不清楚是否其机体微生物群落之间也存在一定的差异;为了研究不同人群机体中肠道微生物组的差异,研究者Yatsunenko等人对生活在不同地区(包括委内瑞拉亚马逊地区、马拉维农村地区和美国大都市地区)的人群粪便中的样本种类进行了特征分析,结果发现,在地理位置不同的人群中,其机体肠道微生物群落的组成和功能之间存在着显著差异[5]。
图片来源:S. Bradbrook/Springer Nature Limited
里程碑21—2013年
微生物群落产生的短链脂肪酸或能诱导调节性T细胞的产生
调节性T细胞(Treg)在维持机体免疫稳态上扮演着非常重要的角色,2013年三项研究表明,微生物群落所产生的短链脂肪酸能够促进Treg的扩张和分化,这就揭示了机体共生微生物群落与影响免疫机制的免疫系统之间存在的一种化学介导的沟通方式[6-8]。
里程碑22—2014年
人类微生物群落能够产生抗生素
研究人员在人类微生物群落的基因组中鉴别出了抗生素合成基因组簇,这就揭示了抗菌药物的新型来源,同时种群特异性的产生也能够潜在调节局部微生物群落的结构[9]。
里程碑23—2015年
宿主靶向性药物或会影响微生物群落的组成
常用的药物会影响肠道微生物的丰度及细菌基因的表达,其对与药物治疗相关的人类健康既有积极作用,也有消极作用[10-12]。
里程碑24—2018年
人类微生物组或会影响机体对癌症疗法的反应
在对小鼠模型的早期研究中,研究者发现,肠道微生物的组成或会影响黑色素瘤、晚期肺癌或肾癌患者对检查点抑制剂疗法及肿瘤控制疗法的反应[13-15]。
里程碑25—2019年
宏基因组组装的基因组或能提供人类相关微生物群落前所未有的特性
随着计算方法的进步,尤其是最近在环境微生物学研究中的应用,如今研究人员就能够利用计算方法来通过宏基因组数据库重建细菌的基因组,这种方法能够用来鉴别来自肠道和机体其它位点的数千种无法进行培养的细菌,这就极大扩展了我们已知微生物群落系统发育的多样性,并能够改善对非西方种群的研究和分类[16-18]。
参考资料:
【1】Peppercorn, M. A. & Goldman, P. The role of intestinal bacteria in the metabolism of salicylazosulfapyridine. J. Pharmacol. Exp. Ther. 181, 555–562 (1972).
【2】Klaassens, E. S., de Vos, W. M. & Vaughan, E. E. Metaproteomics approach to study the functionality of the microbiota in the human infant gastrointestinal tract. appl. Environ. Microbiol. 73, 1388–1392 (2007).
【3】Caporaso, J. G. et al. QIIME allows analysis of high-throughput community sequencing data. Nat. Methods 7, 335–336 (2010).
【4】Goodman, A. L. et al. Extensive personal human gut microbiota culture collections characterized and manipulated in gnotobiotic mice. Proc. Natl Acad. Sci. USA 108, 6252–6257 (2011)
【5】Yatsunenko, T. et al. Human gut microbiome viewed across age and geography. Nature 486, 222–227 (2012).
【6】Smith, P.M. et al. The microbial metabolites, short-chain fatty acids, regulate colonic Treg cell homeostasis. Science 341, 569–573 (2013)
【7】Atarashi, K. et al. Treg induction by a rationally selected mixture of Clostridia strains from the human microbiota. Nature 500, 232–236 (2013)
【8】Arpaia, N. et al. Metabolites produced by commensal bacteria promote peripheral regulatory T-cell generation. Nature 504, 451–455 (2013)
【9】Donia, M. S. et al. A systematic analysis of biosynthetic gene clusters in the human microbiome reveals a common family of antibiotics. Cell 158, 1402–1414 (2014).
【10】Tsuda A et al. Influence of proton-pump inhibitors on the luminal microbiota in the gastrointestinal tract. Clin. Transl. Gastroenterol. 6, e89 (2015)
【11】Freedberg, D. E. et al. Proton pump inhibitors alter specific taxa in the human gastrointestinal microbiome:a crossover trial. Gastroenterology 149, 883–885 (2015)
【12】Forslund, K. et al. Disentangling type 2 diabetes and metformin treatment signatures in the human gut microbiota. Nature 528, 262–266 (2015).
【13】Routy, B. et al. Gut microbiome influences efficacy of PD-1-based immunotherapy against epithelial tumors. Science 359, 91–97 (2018)
【14】Gopalakrishnan, V. et al. Gut microbiome modulates response to anti-PD-1 immunotherapy in melanoma patients Science 359, 97–103 (2018)
【15】Matson, V. et al. The commensal microbiome is associated with anti-PD-1 efficacy in metastatic melanoma patients. Science 359, 104–108 (2018)
【16】Pasolli, E. et al. Extensive unexplored human microbiome diversity revealed by over 150,000 genomes from metagenomes spanning age, geography, and lifestyle. Cell 176, 649–662 (2019)
【17】Almeida, A. et al. A new genomic blueprint of the human gut microbiota. Nature 568, 499–504 (2019)
【18】Nayfach, S. et al. New insights from uncultivated genomes of the global human gut microbiome. Nature 568, 505–510 (2019)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。