聚焦单克隆抗体药物技术瓶颈
来源:本站原创 2019-05-28 06:45
2019年5月28日讯/生物谷BIOON/---抗体是由B细胞转化而来的浆细胞分泌的,每个B细胞株只能产生一种它专有的、针对一种特异性抗原决定簇的抗体。这种从一株单一细胞系产生的抗体就叫单克隆抗体(McAb),简称单抗。第一代单抗来自于Koehler和Milstein于1975年开发出的杂交瘤(hybridoma)抗体技术:在细胞融合技术的基础上,将能够分泌特异性抗体的小鼠致敏B细胞和具有无限繁殖
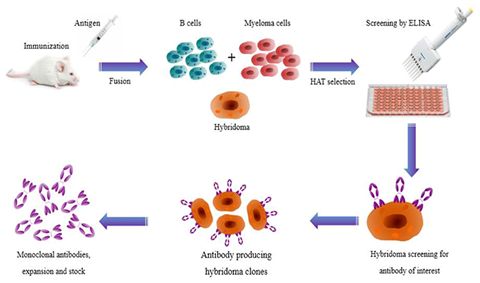
2019年5月28日讯/生物谷BIOON/---抗体是由B细胞转化而来的浆细胞分泌的,每个B细胞株只能产生一种它专有的、针对一种特异性抗原决定簇的抗体。这种从一株单一细胞系产生的抗体就叫单克隆抗体(McAb),简称单抗。第一代单抗来自于Koehler和Milstein于1975年开发出的杂交瘤(hybridoma)抗体技术:在细胞融合技术的基础上,将能够分泌特异性抗体的小鼠致敏B细胞和具有无限繁殖能力的小鼠骨髓瘤细胞融合为B细胞杂交瘤,用具备这种特性的单个杂交瘤细胞培养成细胞群,可制备针对一种抗原表位的特异性抗体,即单克隆抗体(monoclonal antibody,Mab),简称单抗,如图1所示。但是,人体免疫系统能够识别鼠源性单抗,会引起人抗鼠抗体反应(HAMA),这不仅让治疗性单抗药物半衰期变短,疗效减弱,有时还会引起严重的不良反应,因此第一代单抗的临床应用受到了很大限制。
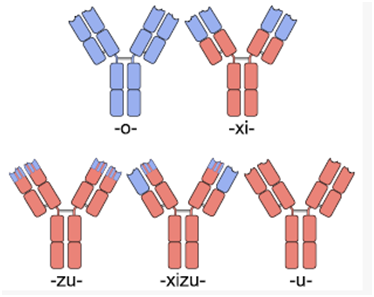
自从1986年全球第一个鼠源性单抗药物Muromonab OKT3问世,全球已近有80个单抗药物上市。迄今为止,单抗药物已经发展到了第四代:第一代为鼠源单抗(momab),第二代为人鼠嵌合型单抗(ximab),第三代为人源化单抗(zumab),第四代为全人源化单抗(mumab)。人源化单抗和全人源化单抗的优势在于可以克服人抗鼠抗体反应,可避免单抗分子被免疫系统当作异源蛋白而被快速清除,提高单抗分子的生物学活性。特别地,全人源化单抗的可变区和恒定区都是人源的,可在人源化单抗的基础上进一步去除免疫原性和毒副作用。人源化单抗药物和全人源化单抗药物具有高亲和力、高特异性以及毒副作用小的特点,极大地克服了鼠源单抗和人鼠嵌合型单抗药物的各种缺点,因而已经成为了治疗性抗体药物发展的必然趋势。
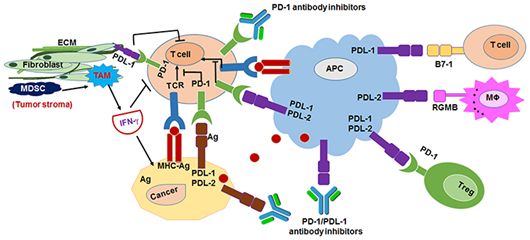
单抗药物作用的靶点通常为细胞表面的疾病相关抗原或特定的受体,比如位于肿瘤细胞表面上的受体PD-1和位于T细胞表面上的配体PD-L1。在单抗药物中,风头正劲的PD-1/PD-L1抑制剂就属于单抗药物,是近年来肿瘤免疫疗法研究的热点。已上市的纳武单抗和派姆单抗属于PD-1抑制剂,主要用于黑素瘤和非小细胞肺癌的治疗,对肾细胞癌、膀胱癌、霍奇金淋巴瘤等的疗效还在大规模临床试验中。PD-L1抑制剂阿替珠单抗(atezolizumab,商品为Tecentriq)、度伐单抗(durvalumab,商品名为Imfinzi)和阿维单抗(avelumab,商品名Bavencio)已被批准用于治疗尿道上皮癌,还有其他几种药物尚处于早期临床试验阶段。2018年9月28日,FDA批准了由赛诺菲(Sanofi)和再生元(Regeneron)联合研发的Libtayo(cemiplimab-rwlc)上市,用于治疗转移性皮肤鳞状细胞癌(CSCC)或不能接受治愈性手术或放疗的局部晚期CSCC患者。这也是由FDA批准获批上市的第3款抗PD-1抗体。
截至目前,单抗药物已经成为生物医药的重要组成部分,在医药治疗上也具有广阔的应用前景,已经被成功用于治疗肿瘤、自身免疫性疾病、感染性疾病和移植排斥反应等多种疾病。但是,在制备单抗药物技术中面临着不少瓶颈。当前,抗体药物研发的瓶颈在于靶分子的筛选,抗体人源化和人抗体制备,抗体的高通量大规模筛选技术,抗原表位的预测、建模和分析技术,抗原-抗体相互作用的立体构型构建和各种增加抗体效应功能的技术等。
1.抗体药物靶标筛选
传统抗体药物研发的方法是在单个基因、单个蛋白及单个抗体水平上研发,首先需要经过许多年的时间研究这个基因和及其编码蛋白的功能,确认是否能够将这个基因及其编码蛋白作为抗体药物靶标来研发抗体药物。这种方法的缺点主要在于:所获得的抗体药物靶标的数量极其有限,并且这些靶标都是十多年前就已发现的;历时长,一般需要十到二十年的时间。随着基因组学、转录组学、蛋白质组学和测序技术研究不断取得进展,人们发现的新基因和新蛋白的数量越来越多,从而有望从中挑选出合适的抗体药物靶标。
抗体药物靶标筛选的标准是什么呢?以抗肿瘤弹药药物靶标为例,首先靶标表达要有差异,比如在正常组织和肿瘤组织要有差异,或者在关键宿主器官中表达缺失,或者在疾病进展中一直表达。其次,靶标要起到作用,当使用抗体进行治疗时,抗原不能轻易地酶降解掉。从已知治疗靶标产生高亲和力的抗体不是主要障碍,主要挑战是筛选靶分子。
如今,科学家们已采用人抗体技术和全人抗体技术,希望通过人体免疫系统找到一些更好的抗体靶标,从而开发出疗效更好的抗体药物。全人抗体技术是通过人-鼠杂交瘤技术、人-人杂交瘤技术、B细胞永生化和我们在这些技术上通过改进产生的高效高通量全人抗体库技术,抗体的选择、成熟和产生都是在人体中形成的,因而是严格意义上的全人抗体。抗体靶标的确定、抗体的产生和转录后修饰都是由人体的免疫系统经过一系列筛选后完成,这种技术产生的抗体具有天然的最佳亲和力和结合力,并且更有效地作用于人体。高效高通量全人抗体库技术将能够分泌抗体的目的细胞分离、纯化、富集和增殖。B细胞亚克隆后所分泌的抗体的特异性可通过ELISPOT、ELISA或溶血空斑试验进行筛选和鉴定。从单克隆培养的细胞株中获取目的抗体的基因序列,构建原核或真核表达载体,转入工程菌或细胞进行表达,就可重建抗体的活性。
2.单抗药物的免疫原性分析
目前已在临床使用的单抗药物常见的不良反应主要是由它们的免疫原性引起的。免疫原性引起的抗药物抗体对药物的安全性和有效性有很大影响。免疫原性的强弱是生物技术药物开发的决定因素之一,因此在评价药物安全性时,需同时考虑它们的免疫原性。为此,科学家们分别采取抗体人源化、改善溶解特性、蛋白修饰(比如蛋白聚乙二醇化修饰)和改善效应分子功能(可通过构建随意突变CDR或整个可变区结构域的高通量文库,然后从中筛选高亲和力变异体,或者模拟体内亲和力成熟的显著突变或热点突变基因构建小容量文库)等措施来改善单抗药物的免疫原性。
当前评价和分析单抗药物免疫原性的方法为酶联免疫分析法、液相-质谱联用、表面等离子共振法、电化学发光法和放射免疫分析法等。但是,这些方法存在免疫原性临界值的判断尚无统一定论,而且免疫原性的临界值因分布规律、计算公司等不同而存在差异,这就使得不同药物间的接受标准无法统一。不过,随着分子生物学技术的不断取得进展,提高单抗药物的人源化成分,甚至达到全人源抗体,改善它们的结合和效应分子功能,再结合蛋白修饰,有望避免单抗药物的免疫原性。与此同时,完善免疫原性检测方法,让它统一化、标准化,使得临床试验具有明确的指导原则,最终加快单抗药物的临床应用。
3.高通量的动物细胞表达技术
从蛋白表达体系而言,近年来,科学家们不足开发和优化了很多抗体分子的表达体系,比如,细菌、酵母、昆虫细胞、哺乳动物细胞、植物细胞表达系统和体外表达系统等。其中,哺乳动物细胞表达系统具有活性高、稳定性好等重要优点,已成为抗体生物技术产品制造的最为重要的表达体系。
从抗体制备规模、速度和功能来看,高通量抗体制备技术的发展十分重要。哺乳动物细胞表达生物技术产品大规模高效培养技术是生物医药产品的主要生产方式和关键瓶颈技术。目前国际上这方面的技术有流加培养技术和灌流培养技术。
4.人源化抗体和全人源化抗体构建和优化技术
随着免疫学和分子生物学技术的不断发展,DNA重组技术越来越多地用于抗体构建和优化。针对人源化抗体的构建和优化技术有表面重塑抗体(resurfacing antibody)和重构抗体(reshaped antibody)。表面重塑抗体是指对异源抗体表面氨基酸残基进行人源化改造。该方法的原则是仅替换与人抗体表面可及残基(SAR)差别明显的区域,在维持抗体活性并兼顾减少异源性基础上选用与人抗体表面残基相似的氨基酸替换;另外,所替换的区段不应过多,对于影响侧链大小、电荷、疏水性,或可能形成氢键从而影响到抗体互补决定区(CDR)构象的残基尽量不替换。重构抗体指由异源抗体中与抗原结合相关的残基与人抗体重新剪接构建的抗体,包括互补决定区移植、部分补决定区移植和特定决定区转移。
全人源化抗体的轻链和重链都来源于人,是治疗性抗体的发展趋势。目前针对全人源化抗体的构建和优化技术有抗体库筛选技术,如链置换、基因工程小鼠制备全人源化抗体。比较成熟的抗体库筛选技术有:噬菌体抗体库、合成抗体库和核糖体展示技术。
抗体组技术是在基因组学和蛋白组学基础上,结合杂交瘤技术及基因工程抗体技术,经过抗体靶标高通量筛选、建立大规模抗体库,最终走向应用。相比传统的单克隆抗体技术相比,抗体库技术,具有库容量大、可筛选种类多、更易获得针对特定抗原表位的高活性单克隆抗体等无以替代的优势。同时抗体库技术在筛选过程中,更为省时、省力、高效、经济。
小鼠目前依然是最容易进行免疫和其后续进行基因工程操作的动物品种,然而通过小鼠抗体库获得的依然是鼠抗体V区基因,想使其安全用于临床,还必须进行后续的人源化改造。近两年发展的全人抗体的转基因小鼠技术,使得我们可以通过转有全套人抗体基因的转基因小鼠来制备人的免疫抗体库,并从中直接筛选具有治疗价值全人的抗体V区基因,无需人源化的改造。
5.新型抗体药物开发
传统抗体药物通过封闭单一信号通路抑制肿瘤生长,临床上易出现抗体药物的耐药性。所以双特异性抗体(BsAb)应运而生,其通过基因工程手段将两个分别靶向不同抗原的抗体片段组合在一起,具有两种抗原结合位点,可以发挥协同作用,进而提高治疗效果。这种结构设计能有效地改善抗体药物在体内的药物代谢动力学过程,增强临床治疗效果。然而,设计出疗效好、稳定性高且利于生产的BsAb仍需深入研究。
近年来上市的抗体药物反映了下一代抗体药物开发的新趋势:第一个方向是让抗体药物具有更小的分子量,以便具有更好的药代动力学和药效学参数,更便于大规模制造,比如Fab片段、Fab'片段、F(ab')2片段、单链抗体(scFv)、单区抗体(sdAb)、双链抗体(diabody)、三链抗体(triabody)和微小型抗体(minibody);第二个方向是根据已知的药物分子,将至少两个具有某种生物功能的分子连接在一起形成融合蛋白,比如双特异性抗体、三功能抗体(trifunctional antibody)、合成抗体(synbody)、抗体-药物偶联物(ADC)。
抗体-药物偶联物由单抗与有治疗作用的小分子药物两部分构成,借助抗体实现化学药物对肿瘤组织的靶向递送。抗体-药物偶联物在血液中稳定性高,药物分子不会脱落,因而毒副作用较小,但对肿瘤细胞的抑制作用远远高于裸抗体。这种设计策略既可提高抗体药物的杀伤能力,又提高小分子化学药物的治疗窗。
单抗药物为多种疾病的治疗提供了新的途径,目前单抗药物已广泛应用于肿瘤等多种疾病的临床治疗。从国内单抗抗肿瘤药物研发流程来看,主要分为靶点发现、靶点选择、抗原制备、单克隆抗体制备技术的选择以及抗体功能鉴定5个部分。在各个环节中,可以通过不同环节的技术特点发现影响研发成果的风险因素,找到风险因素,并运用风险管理的思维和方法进行分析。单抗药物制备过程中采用的不同技术,都会遇到不同的挑战。为此,这就需要开发者针对具体问题进行具体分析,不断克服这些技术挑战,方能开发出真正有用的单抗药物,为患者带来新的救命药。(生物谷 Bioon.com)
参考文献:
1. 倪健. 单克隆抗体药物研制的关键技术之一:抗体药物靶标筛选. 中国医药技术经济与管理[J], 2012, 4:41-45.
2. 宋文娅等人. 单克隆抗体类药物的免疫原性分析. 中国新药杂志[J]. 2016, 25(1):2462-2465.
3. 刘美君等. Fab类抗体的研究进展. 国际药学研究杂志[J]. 2014, 41(3):318-324.
4. 陈立慧等. 治疗性人源化单克隆抗体研究进展.中国新药杂志[J]. 2004, 13(7):590-594.
5. 史久华编译. 全人单克隆抗体与人源化单克隆抗体. 《国外医学》预防、诊断、治疗用生物制品分册[J]. 2002, 25(1):28-32.
6. 葛彦. 人源化抗体研制策略分析及应用研究. 国外医学免疫学分册[J]. 2004, 27(5):271-274.
7. 李国坤等. 哺乳动物细胞表达系统研究进展.中国生物工程杂志[J]. 2014, 34(1):95-100.

图1.杂交瘤抗体技术示意图,图片来自Frontiers in Microbiology, 2017, doi:10.3389/fmicb.2017.00495。
自从1986年全球第一个鼠源性单抗药物Muromonab OKT3问世,全球已近有80个单抗药物上市。迄今为止,单抗药物已经发展到了第四代:第一代为鼠源单抗(momab),第二代为人鼠嵌合型单抗(ximab),第三代为人源化单抗(zumab),第四代为全人源化单抗(mumab)。人源化单抗和全人源化单抗的优势在于可以克服人抗鼠抗体反应,可避免单抗分子被免疫系统当作异源蛋白而被快速清除,提高单抗分子的生物学活性。特别地,全人源化单抗的可变区和恒定区都是人源的,可在人源化单抗的基础上进一步去除免疫原性和毒副作用。人源化单抗药物和全人源化单抗药物具有高亲和力、高特异性以及毒副作用小的特点,极大地克服了鼠源单抗和人鼠嵌合型单抗药物的各种缺点,因而已经成为了治疗性抗体药物发展的必然趋势。
单抗药物作用的靶点通常为细胞表面的疾病相关抗原或特定的受体,比如位于肿瘤细胞表面上的受体PD-1和位于T细胞表面上的配体PD-L1。在单抗药物中,风头正劲的PD-1/PD-L1抑制剂就属于单抗药物,是近年来肿瘤免疫疗法研究的热点。已上市的纳武单抗和派姆单抗属于PD-1抑制剂,主要用于黑素瘤和非小细胞肺癌的治疗,对肾细胞癌、膀胱癌、霍奇金淋巴瘤等的疗效还在大规模临床试验中。PD-L1抑制剂阿替珠单抗(atezolizumab,商品为Tecentriq)、度伐单抗(durvalumab,商品名为Imfinzi)和阿维单抗(avelumab,商品名Bavencio)已被批准用于治疗尿道上皮癌,还有其他几种药物尚处于早期临床试验阶段。2018年9月28日,FDA批准了由赛诺菲(Sanofi)和再生元(Regeneron)联合研发的Libtayo(cemiplimab-rwlc)上市,用于治疗转移性皮肤鳞状细胞癌(CSCC)或不能接受治愈性手术或放疗的局部晚期CSCC患者。这也是由FDA批准获批上市的第3款抗PD-1抗体。

图2.PD-1/PD-L1抑制剂作用机制,图片来自Frontiers in Pharmacology,2017, doi:10.3389/fphar.2017.00561。
截至目前,单抗药物已经成为生物医药的重要组成部分,在医药治疗上也具有广阔的应用前景,已经被成功用于治疗肿瘤、自身免疫性疾病、感染性疾病和移植排斥反应等多种疾病。但是,在制备单抗药物技术中面临着不少瓶颈。当前,抗体药物研发的瓶颈在于靶分子的筛选,抗体人源化和人抗体制备,抗体的高通量大规模筛选技术,抗原表位的预测、建模和分析技术,抗原-抗体相互作用的立体构型构建和各种增加抗体效应功能的技术等。
1.抗体药物靶标筛选
传统抗体药物研发的方法是在单个基因、单个蛋白及单个抗体水平上研发,首先需要经过许多年的时间研究这个基因和及其编码蛋白的功能,确认是否能够将这个基因及其编码蛋白作为抗体药物靶标来研发抗体药物。这种方法的缺点主要在于:所获得的抗体药物靶标的数量极其有限,并且这些靶标都是十多年前就已发现的;历时长,一般需要十到二十年的时间。随着基因组学、转录组学、蛋白质组学和测序技术研究不断取得进展,人们发现的新基因和新蛋白的数量越来越多,从而有望从中挑选出合适的抗体药物靶标。
抗体药物靶标筛选的标准是什么呢?以抗肿瘤弹药药物靶标为例,首先靶标表达要有差异,比如在正常组织和肿瘤组织要有差异,或者在关键宿主器官中表达缺失,或者在疾病进展中一直表达。其次,靶标要起到作用,当使用抗体进行治疗时,抗原不能轻易地酶降解掉。从已知治疗靶标产生高亲和力的抗体不是主要障碍,主要挑战是筛选靶分子。
如今,科学家们已采用人抗体技术和全人抗体技术,希望通过人体免疫系统找到一些更好的抗体靶标,从而开发出疗效更好的抗体药物。全人抗体技术是通过人-鼠杂交瘤技术、人-人杂交瘤技术、B细胞永生化和我们在这些技术上通过改进产生的高效高通量全人抗体库技术,抗体的选择、成熟和产生都是在人体中形成的,因而是严格意义上的全人抗体。抗体靶标的确定、抗体的产生和转录后修饰都是由人体的免疫系统经过一系列筛选后完成,这种技术产生的抗体具有天然的最佳亲和力和结合力,并且更有效地作用于人体。高效高通量全人抗体库技术将能够分泌抗体的目的细胞分离、纯化、富集和增殖。B细胞亚克隆后所分泌的抗体的特异性可通过ELISPOT、ELISA或溶血空斑试验进行筛选和鉴定。从单克隆培养的细胞株中获取目的抗体的基因序列,构建原核或真核表达载体,转入工程菌或细胞进行表达,就可重建抗体的活性。
2.单抗药物的免疫原性分析
目前已在临床使用的单抗药物常见的不良反应主要是由它们的免疫原性引起的。免疫原性引起的抗药物抗体对药物的安全性和有效性有很大影响。免疫原性的强弱是生物技术药物开发的决定因素之一,因此在评价药物安全性时,需同时考虑它们的免疫原性。为此,科学家们分别采取抗体人源化、改善溶解特性、蛋白修饰(比如蛋白聚乙二醇化修饰)和改善效应分子功能(可通过构建随意突变CDR或整个可变区结构域的高通量文库,然后从中筛选高亲和力变异体,或者模拟体内亲和力成熟的显著突变或热点突变基因构建小容量文库)等措施来改善单抗药物的免疫原性。

抗体聚乙二醇化修饰,图片来自Scientific Reports, 2017, doi:10.1038/s41598-017-15051-y。
当前评价和分析单抗药物免疫原性的方法为酶联免疫分析法、液相-质谱联用、表面等离子共振法、电化学发光法和放射免疫分析法等。但是,这些方法存在免疫原性临界值的判断尚无统一定论,而且免疫原性的临界值因分布规律、计算公司等不同而存在差异,这就使得不同药物间的接受标准无法统一。不过,随着分子生物学技术的不断取得进展,提高单抗药物的人源化成分,甚至达到全人源抗体,改善它们的结合和效应分子功能,再结合蛋白修饰,有望避免单抗药物的免疫原性。与此同时,完善免疫原性检测方法,让它统一化、标准化,使得临床试验具有明确的指导原则,最终加快单抗药物的临床应用。
3.高通量的动物细胞表达技术
从蛋白表达体系而言,近年来,科学家们不足开发和优化了很多抗体分子的表达体系,比如,细菌、酵母、昆虫细胞、哺乳动物细胞、植物细胞表达系统和体外表达系统等。其中,哺乳动物细胞表达系统具有活性高、稳定性好等重要优点,已成为抗体生物技术产品制造的最为重要的表达体系。
从抗体制备规模、速度和功能来看,高通量抗体制备技术的发展十分重要。哺乳动物细胞表达生物技术产品大规模高效培养技术是生物医药产品的主要生产方式和关键瓶颈技术。目前国际上这方面的技术有流加培养技术和灌流培养技术。
4.人源化抗体和全人源化抗体构建和优化技术
随着免疫学和分子生物学技术的不断发展,DNA重组技术越来越多地用于抗体构建和优化。针对人源化抗体的构建和优化技术有表面重塑抗体(resurfacing antibody)和重构抗体(reshaped antibody)。表面重塑抗体是指对异源抗体表面氨基酸残基进行人源化改造。该方法的原则是仅替换与人抗体表面可及残基(SAR)差别明显的区域,在维持抗体活性并兼顾减少异源性基础上选用与人抗体表面残基相似的氨基酸替换;另外,所替换的区段不应过多,对于影响侧链大小、电荷、疏水性,或可能形成氢键从而影响到抗体互补决定区(CDR)构象的残基尽量不替换。重构抗体指由异源抗体中与抗原结合相关的残基与人抗体重新剪接构建的抗体,包括互补决定区移植、部分补决定区移植和特定决定区转移。

嵌合抗体和人源化抗体,图片来自Wikipedia。
全人源化抗体的轻链和重链都来源于人,是治疗性抗体的发展趋势。目前针对全人源化抗体的构建和优化技术有抗体库筛选技术,如链置换、基因工程小鼠制备全人源化抗体。比较成熟的抗体库筛选技术有:噬菌体抗体库、合成抗体库和核糖体展示技术。
抗体组技术是在基因组学和蛋白组学基础上,结合杂交瘤技术及基因工程抗体技术,经过抗体靶标高通量筛选、建立大规模抗体库,最终走向应用。相比传统的单克隆抗体技术相比,抗体库技术,具有库容量大、可筛选种类多、更易获得针对特定抗原表位的高活性单克隆抗体等无以替代的优势。同时抗体库技术在筛选过程中,更为省时、省力、高效、经济。
小鼠目前依然是最容易进行免疫和其后续进行基因工程操作的动物品种,然而通过小鼠抗体库获得的依然是鼠抗体V区基因,想使其安全用于临床,还必须进行后续的人源化改造。近两年发展的全人抗体的转基因小鼠技术,使得我们可以通过转有全套人抗体基因的转基因小鼠来制备人的免疫抗体库,并从中直接筛选具有治疗价值全人的抗体V区基因,无需人源化的改造。
5.新型抗体药物开发
传统抗体药物通过封闭单一信号通路抑制肿瘤生长,临床上易出现抗体药物的耐药性。所以双特异性抗体(BsAb)应运而生,其通过基因工程手段将两个分别靶向不同抗原的抗体片段组合在一起,具有两种抗原结合位点,可以发挥协同作用,进而提高治疗效果。这种结构设计能有效地改善抗体药物在体内的药物代谢动力学过程,增强临床治疗效果。然而,设计出疗效好、稳定性高且利于生产的BsAb仍需深入研究。
近年来上市的抗体药物反映了下一代抗体药物开发的新趋势:第一个方向是让抗体药物具有更小的分子量,以便具有更好的药代动力学和药效学参数,更便于大规模制造,比如Fab片段、Fab'片段、F(ab')2片段、单链抗体(scFv)、单区抗体(sdAb)、双链抗体(diabody)、三链抗体(triabody)和微小型抗体(minibody);第二个方向是根据已知的药物分子,将至少两个具有某种生物功能的分子连接在一起形成融合蛋白,比如双特异性抗体、三功能抗体(trifunctional antibody)、合成抗体(synbody)、抗体-药物偶联物(ADC)。
抗体-药物偶联物由单抗与有治疗作用的小分子药物两部分构成,借助抗体实现化学药物对肿瘤组织的靶向递送。抗体-药物偶联物在血液中稳定性高,药物分子不会脱落,因而毒副作用较小,但对肿瘤细胞的抑制作用远远高于裸抗体。这种设计策略既可提高抗体药物的杀伤能力,又提高小分子化学药物的治疗窗。

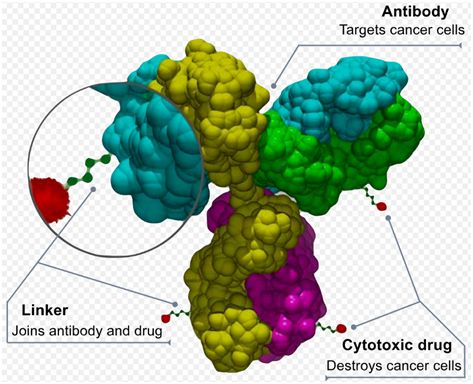
抗体-药物偶联物,图片来自Wikipedia。
单抗药物为多种疾病的治疗提供了新的途径,目前单抗药物已广泛应用于肿瘤等多种疾病的临床治疗。从国内单抗抗肿瘤药物研发流程来看,主要分为靶点发现、靶点选择、抗原制备、单克隆抗体制备技术的选择以及抗体功能鉴定5个部分。在各个环节中,可以通过不同环节的技术特点发现影响研发成果的风险因素,找到风险因素,并运用风险管理的思维和方法进行分析。单抗药物制备过程中采用的不同技术,都会遇到不同的挑战。为此,这就需要开发者针对具体问题进行具体分析,不断克服这些技术挑战,方能开发出真正有用的单抗药物,为患者带来新的救命药。(生物谷 Bioon.com)
参考文献:
1. 倪健. 单克隆抗体药物研制的关键技术之一:抗体药物靶标筛选. 中国医药技术经济与管理[J], 2012, 4:41-45.
2. 宋文娅等人. 单克隆抗体类药物的免疫原性分析. 中国新药杂志[J]. 2016, 25(1):2462-2465.
3. 刘美君等. Fab类抗体的研究进展. 国际药学研究杂志[J]. 2014, 41(3):318-324.
4. 陈立慧等. 治疗性人源化单克隆抗体研究进展.中国新药杂志[J]. 2004, 13(7):590-594.
5. 史久华编译. 全人单克隆抗体与人源化单克隆抗体. 《国外医学》预防、诊断、治疗用生物制品分册[J]. 2002, 25(1):28-32.
6. 葛彦. 人源化抗体研制策略分析及应用研究. 国外医学免疫学分册[J]. 2004, 27(5):271-274.
7. 李国坤等. 哺乳动物细胞表达系统研究进展.中国生物工程杂志[J]. 2014, 34(1):95-100.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


