靶向CD19耗竭B细胞!inebilizumab治疗神经脊髓炎频谱障碍(NMOSD)获美FDA突破性药物资格
来源:本站原创 2019-04-21 11:15
2019年4月21日讯 /生物谷BIOON/ --Viela Bio总部位于美国马里兰州的盖瑟斯堡,该公司是从英国制药巨头阿斯利康(AstraZeneca)旗下全球生物制品研发部门MedImmune拆分出来的一家临床阶段生物制药公司,专注于炎症和自身免疫性疾病领域的创新药物开发。近日,该公司宣布,美国食品和药物管理局(FDA)已授予抗CD19单抗inebilizumab(前称MEDI-551)治疗

2019年4月21日讯 /生物谷BIOON/ --Viela Bio总部位于美国马里兰州的盖瑟斯堡,该公司是从英国制药巨头阿斯利康(AstraZeneca)旗下全球生物制品研发部门MedImmune拆分出来的一家临床阶段生物制药公司,专注于炎症和自身免疫性疾病领域的创新药物开发。
近日,该公司宣布,美国食品和药物管理局(FDA)已授予抗CD19单抗inebilizumab(前称MEDI-551)治疗视神经脊髓炎频谱障碍(NMOSD)的突破性药物资格(BTD)。此前,FDA和欧洲药品管理局(EMA)分别于2016年3月和2017年3月授予了inebilizumab治疗NMOSD的孤儿药资格。
FDA授予inebilizumab BTD,是基于关键性N-MOmentum研究的数据。该研究是一项随机、双模拟、安慰剂对照研究,共入组了231例NMOSD患者,包括存在或不存在AQP4-IgG抗体的患者。研究中,患者随机分为2组,分别接受2次静脉注射inebilizumab单药疗法或安慰剂,并随访6.5个月。之后,患者进入开放标签扩展期,所有患者每6个月一次接受一次inebilizumab治疗。主要终点是从治疗开始到NMOSD发作的时间。
结果显示,该研究达到了主要终点和关键次要终点:与安慰剂组相比,inebilizumab治疗组经历一次NMOSD发作的风险显著降低了77%。此外,与安慰剂组相比,inebilizumab治疗组残疾恶化显著降低。该研究中,inebilizumab具有良好的安全性和可接受的耐受性。
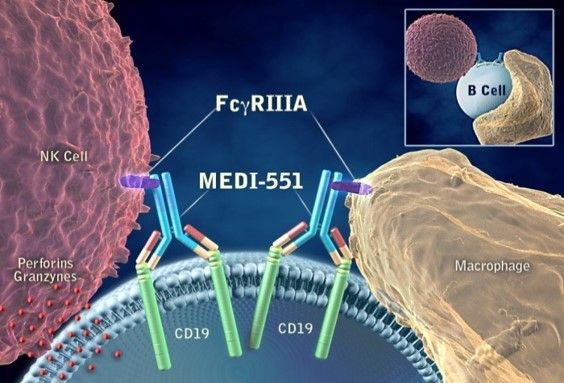
inebilizumab(MEDI-551)作用机制
NMOSD是一种罕见的、破坏性的、补体介导的中枢神经系统自身免疫性疾病,其特征是复发,每次复发都会导致残疾的逐步累积,包括失明和麻痹,有时甚至过早死亡。在NMOSD患者中,大约80%的患者体内存在水通道蛋白-4(AQP4)的自身抗体,这些AQP4-IgG自身抗体被认为是由浆母细胞和浆细胞产生,主要与中枢神经系统中的星形胶质细胞结合。AQP4-IgG抗体与中枢神经系统的结合被认为会引发攻击,从而损害视神经、脊髓和大脑。失明、瘫痪、感觉丧失、膀胱和肠道功能障碍、神经痛和呼吸衰竭都可能是该病的表现。每次NMOSD攻击都会导致进一步的伤害和残疾。NMOSD在女性中更常见,在非白种人中可能更常见。目前还没有治愈或批准治疗NMOSD的药物。
inebilizumab是一种人源化单克隆抗体,与CD19具有很高的亲和力,CD19是一种广泛表达于B细胞的蛋白质,包括分泌抗体的浆母细胞和一些浆细胞。inebilizumab与CD19结合后,这些细胞迅速从循环系统中耗竭。
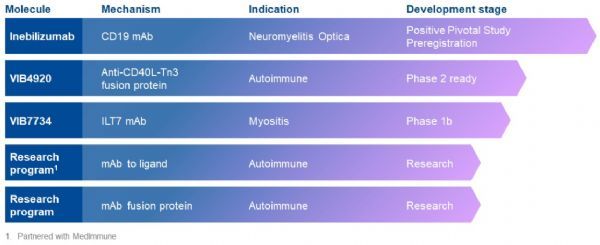
Viela Bio公司管线资产
Viela Bio首席医疗官、研发主管Jorn Drappa医学博士表示,“inebilizumab BTD的授予,是基于在NMOSD领域开展的最大规模的单药治疗研究结果。inebilizumab是一种人源化单克隆抗体,设计用于与CD19高亲和力结合并耗尽广泛的B细胞,包括分泌自身抗体的浆母细胞和表达CD19的浆细胞。我们将继续努力,为患有这种目前尚无批准药物治疗的毁灭性疾病的患者带来创新的疗法。”(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->