阿斯利康“first-in-class”口服小分子获FDA批准上市
中期疗效数据显示,第12周时与安慰剂加Ultomiris或Soliris相比,接受Voydeya加Ultomiris或Soliris患者的血红蛋白水平的最小二乘均值(LSM)相对于基线的变化显著增加。
2024-04-02
新型口服降压药获FDA批准上市
Aprocitentan是一款新型口服双重内皮素A/B受体(ETA/ETB)拮抗剂,可有效抑制ET-1与ETA和ETB的结合,它是马昔腾坦的活性代谢产物,具有更长的半衰期(48h vs. 14h)。
2024-03-22
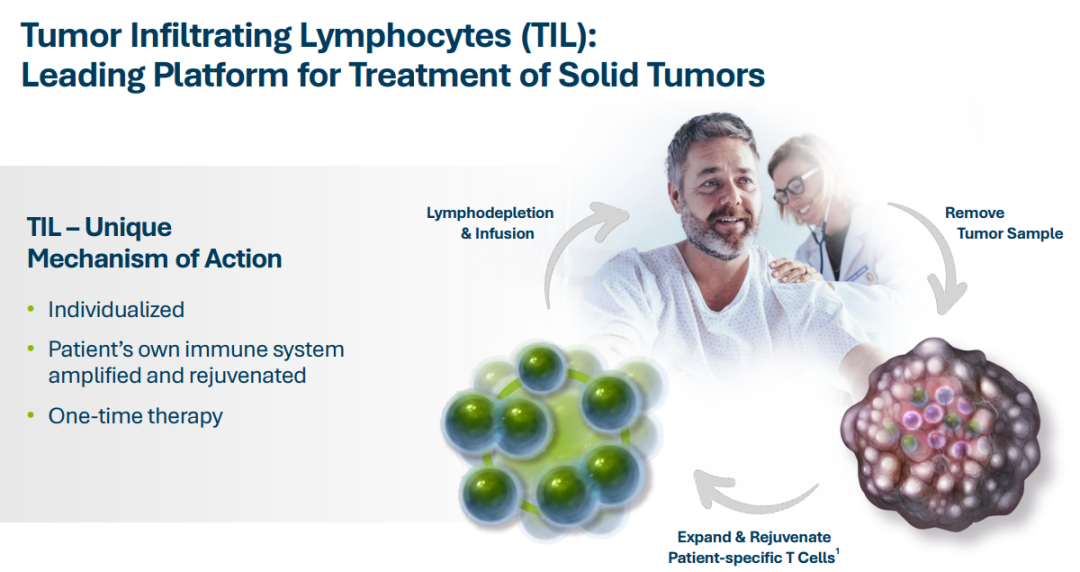
超50款CGT药物上市,药物研发如何“借力”弯道超车?
从上世纪八十年代PCR被发明到1993年首个经FDA批准的PCR试剂盒投放市场,再到此后近30年时间里,科研者为解决实际应用中遇到的新问题,不断对这一技术进行优化,促使PCR经历了初代传统PCR、第二
2023-10-11
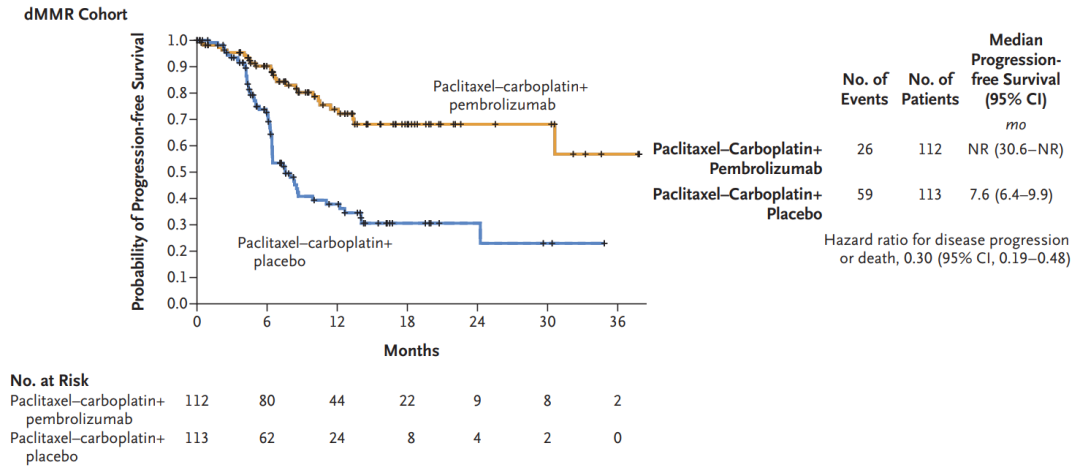
将癌症转移或死亡风险降低62%,Moderna公司mRNA癌症疫苗有望两年内上市
mRNA-4157疫苗的设计目标是根据患者肿瘤的突变特征,通过产生T细胞反应来刺激免疫反应。2023年3月,该mRNA癌症疫苗获得了FDA的突破性疗法认证。
2023-12-19
艾迪康GuardantOMNI®液体活检项目上市,其检测性能与Guardant Health美国实验室一致
艾迪康是中国三大独立医学实验室之一。主要为医院和体检中心提供全面、优质的检测服务,并通过遍布全国的36家自营实验室组成的综合网络,为生物制药客户和医药研发合同外包服务机构(CRO)提供中心实验室服务。
2024-04-01
安士微后生元蜜舒系列新品上市,为女性提供更安全精准的私密健康方案
安士微后生元蜜舒系列,作为安士微解决女性私护烦恼的重磅新品,实力毋庸置疑。未来安士微后生元蜜舒系列将通过前沿的私护知识、高品质产品、陪伴式健康服务,助力女性由内而外拥有健康自在状态,让生命更有质量。
2024-01-23