口服版司美格鲁肽国内获批上市,临床结果显示,可有效降糖、减肥
来源:生物世界 2024-02-05 10:36
诺和诺德、礼来(Eli Lilly)、硕迪生物、先为达,公布开发口服GLP-1类药物的临床数据。
2024年1月26日,国家药监局官网显示,诺和诺德开发的司美格鲁肽片获批上市,用于治疗2型糖尿病。这也是国内首个获批上市的口服GLP-1受体激动剂。此前,注射版司美格鲁肽已于2021年在国内获批上市,同样用于治疗2型糖尿病。
2023年3月24日,诺和诺德发布了口服版司美格鲁肽在治疗2型糖尿病的3b期临床试验的数据。

口服版司美格鲁肽实现高效降糖、减重
这项临床试验对比了更高剂量的口服司美格鲁肽(25mg、50mg)与此前已获批的14mg剂量在治疗2型糖尿病的效果。该临床试验达到主要终点,在治疗第52周时,25mg和50mg剂量的口服司美格鲁肽对糖化血红蛋白(HbA1c)的降低效果显著优于14mg剂量,减重效果也同样显著优于14mg剂量。
该试验达到了其主要终点,在第52周时,25mg和50mg剂量的HbA1c显著降低,优于口服司美格鲁肽14mg剂量的HbA1c降低。
从试验药物角度评估,患者平均基线HbA1c为9.0%,14mg、25mg和50mg剂量组患者HbA1c分别降低了1.5%、1.9%和2.2%;患者平均基线体重为96.4kg,14mg、25mg和50mg剂量组患者体重分别降低了4.5kg、7.0kg和9.2kg。
从治疗策略角度评估,患者平均基线HbA1c为9.0%,14mg、25mg和50mg剂量组患者HbA1c分别降低了1.5%、1.8%和2.0%;患者平均基线体重为96.4kg,14mg、25mg和50mg剂量组患者体重分别降低了4.4kg、6.7kg和8.0kg。

在这项临床试验中,口服司美格鲁肽的各个剂量似乎都具有良好的安全性和耐受性。最常见的不良事件是胃肠道反应,绝大多数为轻度至中度,且会随时间推移而减轻。胃肠道不良事件在剂量增加期间最为突出,口服25mg和50mg组比口服14mg组更频繁。
这项临床试验结果进一步证明了口服司美格鲁肽对2型糖尿病患者的益处。如果需要额外的血糖控制或减肥,25mg和50mg剂量是更高疗效的选择。
除了诺和诺德,礼来(Eli Lilly)、硕迪生物、先为达,也在开发口服GLP-1类药物。
礼来发布2期临床数据

2023年6月,礼来的研究人员在《新英格兰医学杂志》(NEJM)发表了题为:Daily Oral GLP-1 Receptor Agonist Orforglipron for Adults with Obesity 的临床研究论文。
在这项2期临床试验中,礼来开发的口服减肥药物Orforglipron,在最高剂量用药36周后,帮助肥胖者平均减重14.7%,这一效果可与诺和诺德开发的GLP-1受体激动剂司美格鲁肽的注射版的68周治疗效果相媲美。
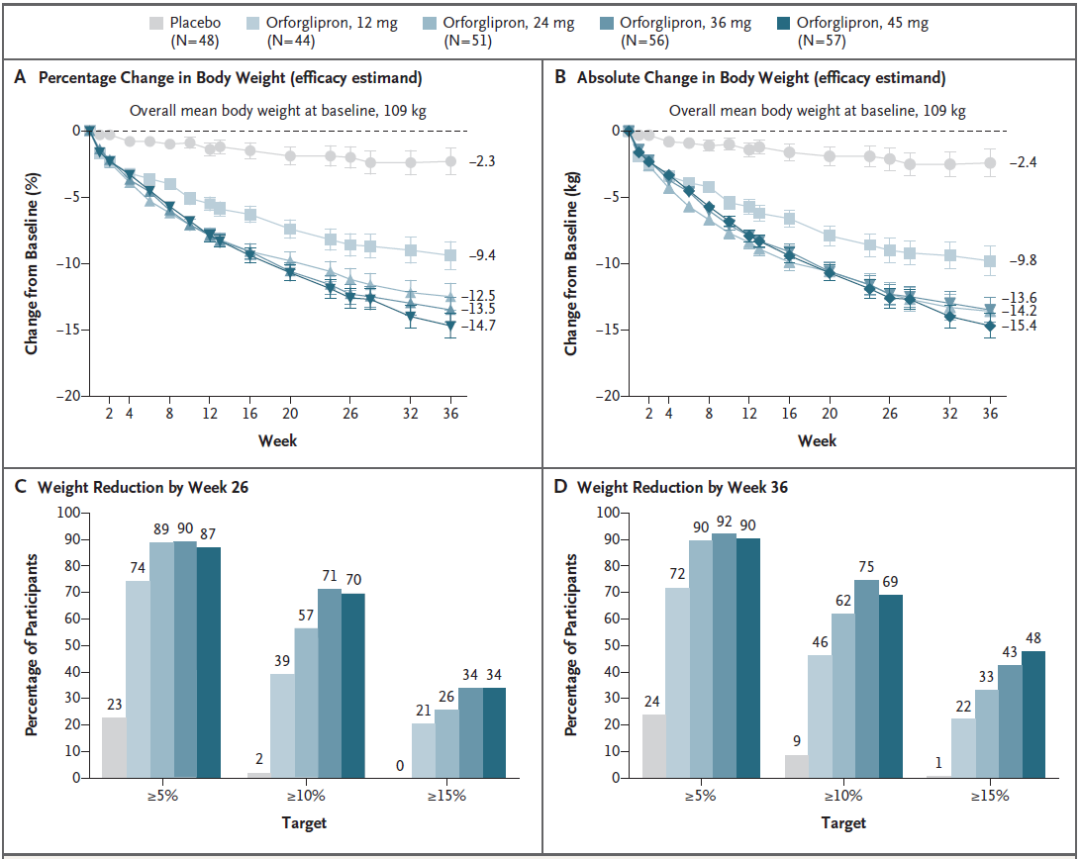
不同剂量组的减重效果
与司美格鲁肽相同的是,Orforglipron也是GLP-1受体激动剂,但不同的是,前者是多肽药物,而后者是小分子药物,因此更适合口服给药。
硕迪生物发布2a期临床数据

2023年12月18日,硕迪生物发布了其小分子口服GLP-1受体激动剂GSBR-1290的2a期临床试验的结果,但这一结果公布后,股价大跌43%。
该2a期临床试验包括一组2型糖尿病患者和一组肥胖症患者,前者接受了两种剂量(45mg、90mg)的GSBR-1290或安慰剂,后者接受了高剂量(120mg)的GSBR-1290或安慰剂,然后跟踪了两组患者的体重变化。
在连续8周的每天用药后,肥胖症患者的体重下降为4.74%,在糖尿病患者中,45mg剂量组12周的体重下降为3.51%,90mg剂量组为3.26%。在糖尿病患者中,第12周时HbA1C(血糖测量指标)的1.01%(45mg剂量)和1.02%(90mg剂量)安慰剂调整降幅。
将这些数字与其他临床试验结果进行比较充满困难,但需要注意的是,在肥胖症患者中,GSBR-1290治疗的肥胖症患者的体重减轻似乎略小于礼来的小分子GLP-1受体激动剂Orforglipron的同期数据(第8周时)。但Orforglipron在第12-36周产生了持续的体重减轻。
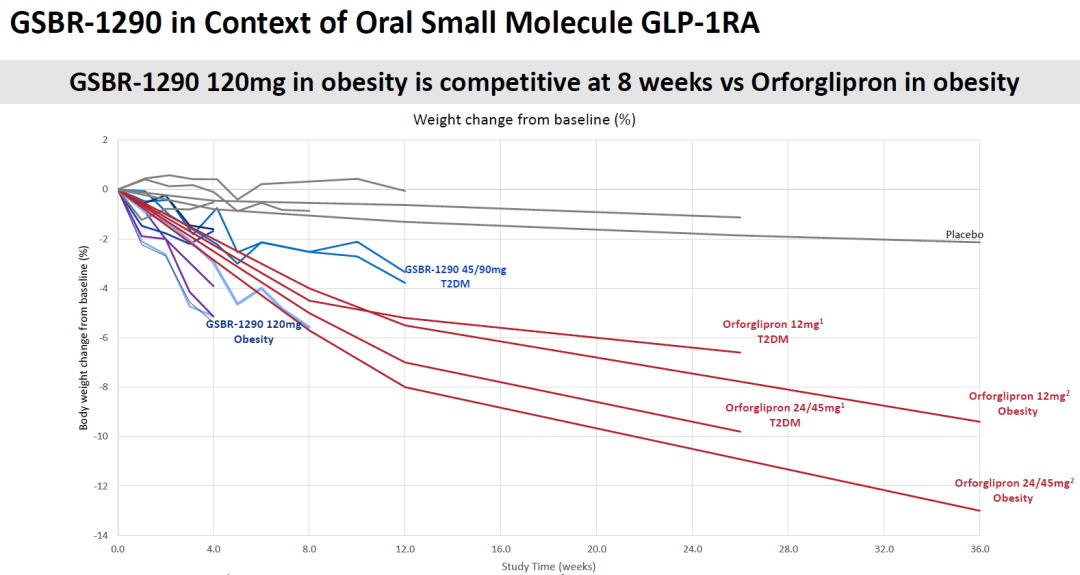
因此,硕迪生物还需要在更多患者中收集更长期的数据,才能获得与其他临床试验更清晰的比较结果。硕迪生物表示,GSBR-1290治疗肥胖症的第12周数据计划在2024年第二季度公布,将在明年年底前进入2b期临床试验。
先为达发布1期临床试验数据

2024年1月24日,先为达公布了其口服GLP-1受体激动剂伊诺格鲁肽(Ecnoglutide)的1期临床数据,试验结果显示,其安全性、耐受性良好,每天一次30mg口服,持续6周,平均体重相对基线降低6.8%。
伊诺格鲁肽(Ecnoglutide)是先为达开发的一种具有cAMP偏向性的长效GLP-1受体激动剂,正在开发用于治疗2型糖尿病和肥胖适应症。口服版伊诺格鲁肽(Oral Ecnoglutide)是一种伊诺格鲁肽的口服制剂。
该1期临床试验是一项随机、双盲、安慰剂对照的多次剂量递增研究,在澳大利亚共招募42名健康受试者(第1-3试验组)和14名健康肥胖受试者(第4试验组)。受试者随机接受每日一次口服伊诺格鲁肽或安慰剂口服片剂,主要评估项目包括口服伊诺格鲁肽的安全性、耐受性、药代动力学和受试者平均体重相对基线的变化。
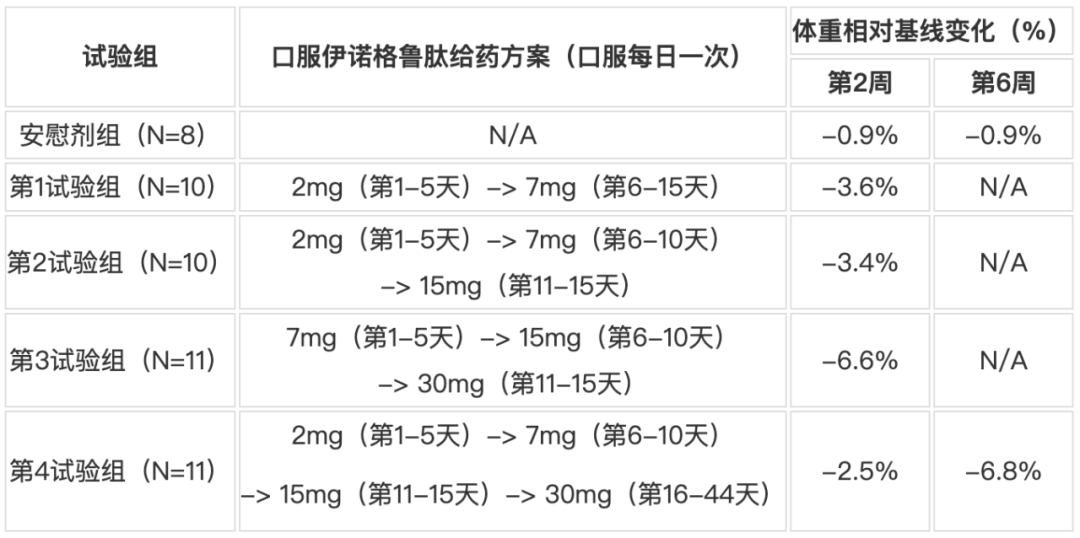
在第1-3试验组中,每日口服一次目标剂量分别为7 mg、15 mg或30 mg的口服伊诺格鲁肽受试者,治疗2周后体重相对基线变化分别为-3.6%、-3.4%和-6.6%,而安慰剂组为-0.9%;在第4试验组中,每天口服一次目标剂量为30mg的口服伊诺格鲁肽肥胖受试者,治疗6周后体重相对基线变化-6.8%,而安慰剂组为-0.9%。药代动力学研究显示,口服伊诺格鲁肽片剂吸收良好。口服伊诺格鲁肽的总体安全性和耐受性与肽类GLP-1激动剂的已知安全性特征一致,最常见的不良事件包括恶心、头痛、腹泻、呕吐和食欲减退,大多数不良事件的严重程度为轻中度,主要发生在剂量递增期。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


