K药新适应症上市申请获FDA受理,一线治疗子宫内膜癌
来源:医药魔方 2024-02-22 09:52
无论肿瘤的错配修复状态如何,K药联合化疗组患者的PFS均较安慰剂组显著延长。
2月20日,默沙东宣布帕博利珠单抗(Keytruda,K药)的补充生物制品许可申请(sBLA)获FDA受理并被予以优先审评,用于联合标准化疗(卡铂和紫杉醇)治疗原发性晚期或复发性子宫内膜癌患者。拟定的PDUFA日期为2024年6月21日。如果获批,K药将成为子宫内膜癌领域首个无视错配修复状态的一线免疫疗法。

此次sBLA主要是基于III期NRG-GY018研究的积极结果。该研究是一项随机、双盲、安慰剂对照临床试验(N=816),评估了K药联合化疗和安慰剂联合化疗治疗错配修复正常(pMMR)型和错配修复缺陷(dMMR)型原发性晚期或复发性子宫内膜癌患者的疗效和安全性。研究的主要终点为无进展生存期(PFS)。
结果显示,无论肿瘤的错配修复状态如何,K药联合化疗组患者的PFS均较安慰剂组显著延长。
在588例可评估疗效的pMMR型子宫内膜癌患者中,中位随访7.9个月时,K药联合化疗组和安慰剂联合化疗组患者的中位PFS分别为13.1个月(95%CI:10.5-18.8)和8.7个月(95%CI:8.4-10.7)。相较于安慰剂联合化疗,K药联合化疗可将患者的疾病进展或死亡风险显著降低46%(HR=0.54,95%CI:0.41-0.71,p<0.00001)。
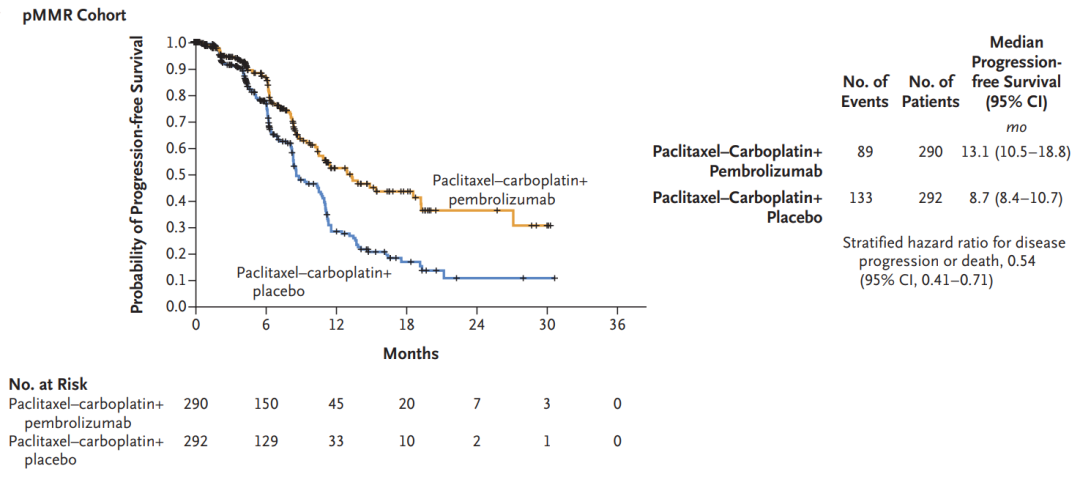
pMMR型队列PFS数据(来源:NEJM)
在225例可评估疗效的dMMR型子宫内膜癌患者中,中位随访12个月时,K药联合化疗组和安慰剂联合化疗组患者的中位PFS分别为尚未达到(95%CI:30.6-NR)和7.6个月(95%CI:6.4-9.9)。相较于安慰剂联合化疗,K药联合化疗可将患者的疾病进展或死亡风险显著降低70%(HR=0.30,95%CI:0.19-0.48,P<0.00001)。
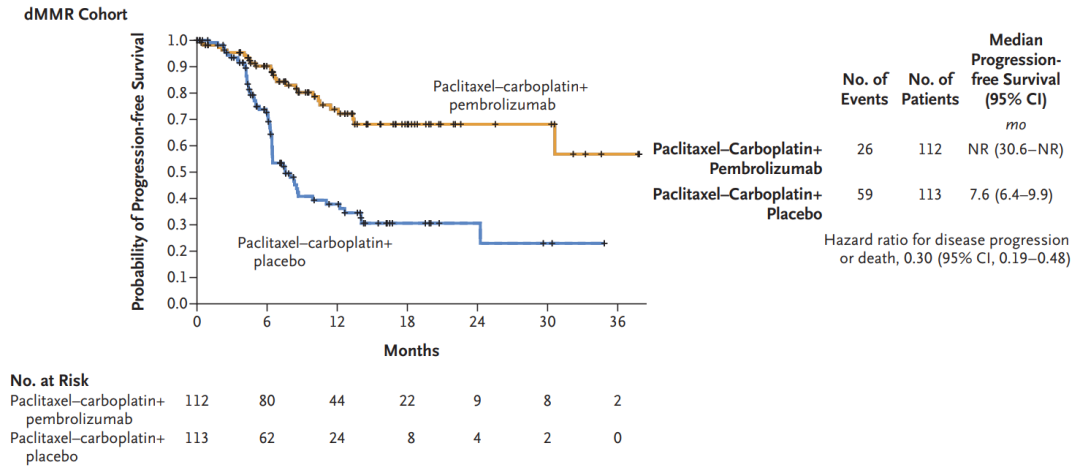
dMMR型队列PFS数据(来源:NEJM)
安全性方面,K药的表现与既往研究一致。在pMMR队列中,K药联合化疗组和安慰剂联合化疗组分别有55.1%和45.3%的患者发生3级以上不良事件(AE);在dMMR队列中,K药联合化疗组和安慰剂联合化疗组分别有63.3%和47.2%的患者发生3级以上AE。
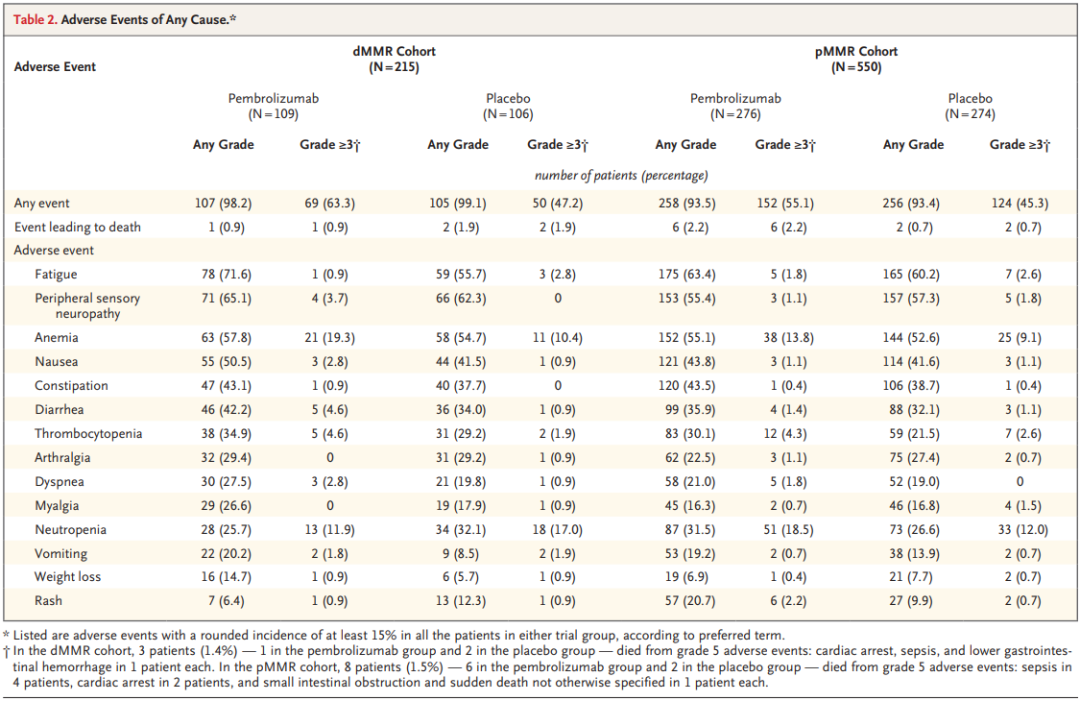
安全性数据(来源:NEJM)
截至目前,K药在子宫内膜癌领域已获批两项适应症:①联合仑伐替尼治疗非微卫星高度不稳定(MSI-H)或pMMR晚期子宫内膜癌患者,这些患者既往接受过系统治疗后疾病进展且不适合进行根治性手术或放疗;②单药治疗MSI-H或dMMR晚期子宫内膜癌患者,这些患者既往接受过系统治疗后疾病进展且不适合进行根治性手术或放疗。
此外,默沙东也在评估K药单药一线治疗MSI-H或dMMR型子宫内膜癌(GOG-3064研究)、联合仑伐替尼一线治疗晚期子宫内膜癌(LEAP-001研究)以及联合化疗辅助治疗切除后子宫内膜癌(GOG-3053研究)的疗效。其中,LEAP-001研究已于去年12月宣告失败,这也是“可乐组合”在肿瘤适应症上的第9次失利。
在子宫内膜癌领域,GSK的PD-1单抗dostarlimab是K药目前唯一的竞争对手。该产品同样获批了经治MSI-H或dMMR晚期子宫内膜癌适应症,并且已先K药一步获批一线治疗子宫内膜癌适应症,但仅限于MSI-H或dMMR型患者。若K药此项sBLA顺利获批,其将成为子宫内膜癌患者的首个无视错配修复状态的一线免疫治疗选择。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


