2021年9月10日Science期刊精华
来源:本站原创 2021-09-14 11:08
2021年9月14日讯/生物谷BIOON/---本周又有一期新的Science期刊(2021年9月10日)发布,它有哪些精彩研究呢?让小编一一道来。1.Science:中瑞科学家联手揭示血清素抑制可卡因成瘾机制doi:10.1126/science.abi9086与人们普遍认为的相反,可卡因只在20%的消费者中引发成瘾。但是,当他们失去对可卡因摄入的控制时,
2021年9月14日讯/生物谷BIOON/---本周又有一期新的Science期刊(2021年9月10日)发布,它有哪些精彩研究呢?让小编一一道来。

图片来自Science期刊。
1.Science:中瑞科学家联手揭示血清素抑制可卡因成瘾机制
doi:10.1126/science.abi9086
与人们普遍认为的相反,可卡因只在20%的消费者中引发成瘾。但是,当他们失去对可卡因摄入的控制时,他们的大脑中会发生什么?在一项新的研究中,得益于一种新的实验方法,来自瑞士日内瓦大学和中国北京大学的研究人员揭示了一种可卡因在大脑中特有的作用机制,这种机制的特殊性在于,除了引发所有毒品摄入都会增加的多巴胺外,还会引发血清素(serotonin,也称为5-羟色胺)的大量增加。事实上,血清素对多巴胺引起的奖励系统的过度兴奋起着内在的制动作用,其中多巴胺是一种导致成瘾的神经递质。相关研究结果发表在2021年9月10日的Science期刊上,论文标题为“Synaptic mechanism underlying serotonin modulation of transition to cocaine addiction”。

二甲-4-羟色胺和血清素的化学结构式,图片来自Wikipedia Commons。
该实验用可卡因不再与血清素转运体相关联的小鼠重复进行,因此在服用可卡因时只有多巴胺增加。60%的小鼠随后出现了成瘾性。在其他使用不影响血清素的奖励系统刺激方案的小鼠中也发现了同样的情况。Lüscher说,“如果给这些小鼠注射血清素,成瘾率就会下降到20%。因此,血清素是可卡因天然的制动因子,在五次中有四次是有效的。”
2.Science:靶向补体因子C1q有望缓解创伤性脑损伤的长期不良影响
doi:10.1126/science.abj2685
创伤性脑损伤(traumatic brain injury, TBI)是导致儿童和成人残疾的一个主要原因。TBI每年影响全世界6900万人,并可导致认知功能障碍、感觉处理困难、睡眠中断和癫痫。这些不良后果大多在TBI后数月或数年后表现出来,是由最初的撞击所造成的间接的继发性损伤所引起。由于原发性损伤基本上是不可逆的,因此,了解继发性损伤在何处、何时以及如何发生,对于预防或治疗TBI后的残疾至关重要。
在一项新的研究中,来自美国加州大学旧金山分校、加州大学欧文分校和格拉斯通研究所的研究人员研究了C1q在创伤后皮质丘脑系统功能损害中的作用,特别强调了C1q表达的时间和位置。相关研究结果发表在2021年9月10日的Science期刊上,论文标题为“Complement factor C1q mediates sleep spindle loss and epileptic spikes after mild brain injury”。
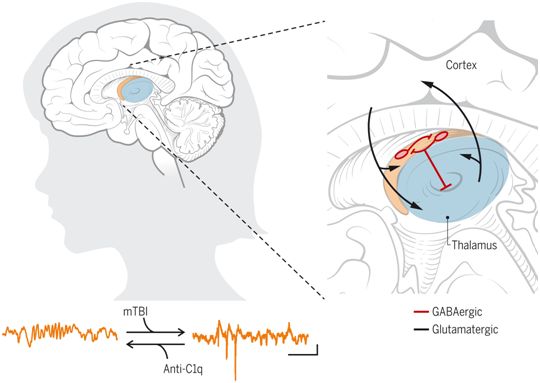
补体因子C1q和网状丘脑介导轻度TBI后慢性脑功能障碍。图片来自Science, 2021, doi:10.1126/science.abj2685。
这些作者发现C1q的表达在损伤部位周围的皮层和功能连接的皮层下丘脑中发生慢性的增加,而丘脑并没有直接受到这种损伤的影响。C1q似乎不是来自丘脑神经元。相反,单核RNA测序显示,小胶质细胞是丘脑C1q的来源。同样地,在经典补体途径中作用于C1下游的C4,在丘脑少突胶质细胞中发生特异性上调。C1q和C4表达增加与神经元丢失和慢性炎症发生的区域相一致,并与睡眠纺锤波(sleep spindle)中断、睡眠早期的脑电图特征和癫痫活动的发展相关。阻断C1q可以抵消所有这些结果。GABA能网状丘脑中的神经元似乎对与C1q有关的继发性损伤特别敏感,这与皮质神经元或兴奋性丘脑皮层神经元不同,后者在没有C1q抑制的情况下在一个慢性时间点恢复。
3.Science:揭示人类核糖体小亚基加工体在核仁中的成熟机制
doi:10.1126/science.abj5338
核糖体通过将核糖体小亚基对信使RNA的解码与核糖体大亚基形成肽键结合在一起,从而在所有细胞中催化蛋白质的合成。由于这两个亚基都由核糖体RNA(rRNA)和核糖体蛋白组成,这种分子机器的组装受到严格的控制。在人类细胞中,200多个核糖体组装因子催化了这两个核糖体亚基的成熟。核糖体组装在核仁中启动,其中核仁是通过多价蛋白质-核酸相互作用形成的生物分子凝聚物。在这个生物分子凝聚物内,形成了第一个稳定的真核生物核糖体小亚基组装中间物---小亚基(SSU)加工体(processome)。在SSU加工体内,70多个蛋白质和一种RNA伴侣,即小核仁核酸(snoRNA)U3,协同工作以实现RNA的折叠、修饰、重排和切割,以及RNA外切体对前体rRNA的靶向降解。与人类疾病有关的核糖体蛋白和核糖体组装因子的突变突出了这一过程的基本性质。
在核仁中的人类SSU加工体的结构、功能和成熟方面知之甚少,因为它通过不同的状态来组装核糖体小亚基。前核糖体颗粒(preribosomal particle)保留在核仁的生物分子凝聚物中,在此之前,人们一直无法对其进行生化和结构表征。为了阐明人类SSU加工体的核小体成熟,从核仁中分离出这些前核糖体颗粒因此是一个关键的障碍。为此,在一项新的研究中,来自美国美国洛克菲勒大学的研究人员开发出一个人类基因组编辑平台,对内源性的SSU加工体进行双等位基因亲和标记,并建立了从核仁中分离它的生化程序,以便进行结构研究。相关研究结果发表在2021年9月10日的Science期刊上,论文标题为“Nucleolar maturation of the human small subunit processome”。
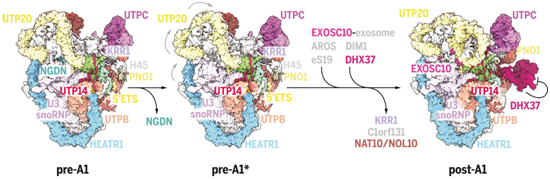
人SSU加工体在核仁中成熟的示意图,图片来自Science, 2021, doi:10.1126/science.abj5338。
通过结合X射线晶体学和低温电镜,这些作者展示了DHX37最初是自抑制的,并通过精确编排的相互作用在SSU加工体上受到严格控制,这种相互作用决定了结合点的可用性和核糖体组装因子UTP14激活肽的可及性。在SSU加工体的核心中,他们确定了一个蛋白质网络,该蛋白质网络引导在A1位点进行切割,从而产生核糖体小亚基RNA的成熟端。最后,人类SSU加工体在post-A1状态下的结构提供了对人类疾病的进一步了解,显示了哺乳动物特异性核糖体组装因子AROS如何让核糖体蛋白eS19保持稳定,其中蛋白eS19在先天性纯红细胞再生障碍性贫血(Diamond-Blackfan anemia)中发生了最大量的突变。
4.Science:新研究揭示无膜细胞区室的内部工作机制
doi:10.1126/science.abg7071
在一项新的研究中,来自美国约翰霍普金斯大学的研究人员指出食品科学原理帮助他们确定了细胞内不寻常的液滴如何保持空间组织性并避免溶解到细胞内部的其他凝胶状部分。他们表示,他们的研究可能促进对细胞进化的科学理解,并帮助食品和化学工业的科学家们开发更好的方法来保持液体混合物不分离开来。相关研究结果发表在2021年9月10日的Science期刊上,论文标题为“Regulation of biomolecular condensates by interfacial protein clusters”。
生物分子凝聚物在20世纪70年代首次被科学家们称为 “颗粒(granule)”,他们使用电子显微镜更仔细地观察包括秀丽隐杆线虫在内的许多有机体中的结构,其中秀丽隐杆线虫相对简单的生物学特性使它们成为研究从现代基因切割技术到蛋白质结构的一个常见实验室模型。线虫体内的生物分子凝聚物,看起来很坚硬,外观类似于沙粒,被称为P颗粒(P granule)。
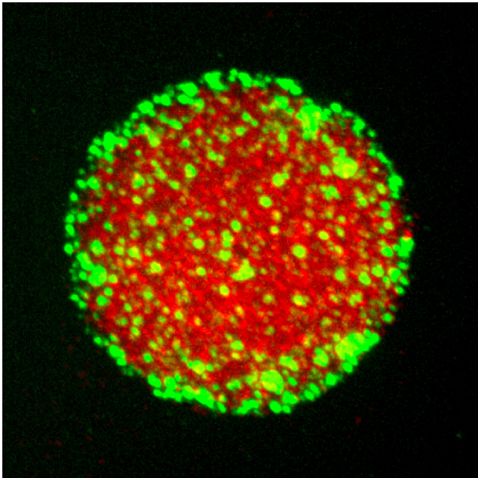
蛋白质凝聚物(红色)由吸附在凝聚物表面的Pickering试剂(绿色)保持稳定。图片来自Andrew Folkmann。
在他们的实验中,Seydoux和她的团队显示,涂有MEG-3的PGL-3液滴在玻璃载玻片上保持均匀分离,与未涂有MEG-3的生物分子凝聚物相比,PGL-3液滴数量多了两倍,而后者融合在一起,在玻璃载玻片上形成更少更大的PGL-3液滴。Seydoux说,“这是食品科学中一个众所周知的现象,如今我们看到它也可能在细胞内发生。”该团队还设计了缺乏MEG-3的线虫卵细胞,并看到未涂有MEG-3的P颗粒溶解得更慢。Seydoux说,这一实验和其他实验表明,MEG-3不仅在正常条件下让这些液滴保持稳定,而且当环境条件发生变化时,这些液滴能够更快地做出反应。在将来自英国帝国理工学院的生物工程师Chiu Fan Lee加入Seydoux团队几个月后,他帮助该团队在MEG-3线虫模型中确定了一个缺失的组分:一种名为MBK-2的酶,帮助P颗粒内部的液体变得不那么粘稠。
5.Science:开发出一种用于寡核苷酸合成的P(V)平台
doi:10.1126/science.abi9727
DNA主要被看作是在碱基序列中编码信息的载体,但磷酸二酯骨架的化学成分对寡核苷酸的稳定性和结构至关重要。在以前合成P(V)硫代磷酸酯偶联化学的工作基础上,Huang等人开发了两种新的试剂,用于制造基于二硫代磷酸酯和基于磷酸酯的连接。这些作者将所有这些试剂纳入一个统一的基于P(V)的合成平台,能够在商用自动化固相合成仪上高效运行。他们通过在特定位置上产生具有所有三种连接类型的寡核苷酸来证明这个系统的灵活性。获得此类精确构建的分子为治疗性寡核苷酸的设计开辟了新途径。
6.Science:揭示血红素-铜氧化酶裂解分子氧机制
doi:10.1126/science.abh3209
分子氧(O2)是线粒体和许多细菌中呼吸作用的终端氧化剂。在膜结合的血红素-铜氧化酶(heme–copper oxidase)中,受控的O2四电子还原成水与质子的跨膜泵送相结合,除其他结果外,可用于生成三磷酸腺苷。在研究细胞色素bo3泛醌氧化酶时,Jose等人使用磁圆二色光谱法研究了关键的PM中间物,它在O-O键裂解后形成,在质子泵送之前形成。这些作者观察到的特征表明,PM是一个三自旋系统,这与包括铁(IV)-氧化物、铜(II)离子和酪氨酸自由基在内的共识模型一致。这些结果为O-O裂解机制提供了一个重要的验证,并为理解质子泵送步骤打开了大门。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


