特应性皮炎(AD)新药!辉瑞新一代口服JAK1抑制剂Cibinqo获全球批准:疗效击败Dupixent(达必妥)!
来源:本站原创 2021-09-10 02:45
Dupixent(达必妥)是全球首个治疗AD的靶向生物制剂,已在中国上市,治疗成人患者。
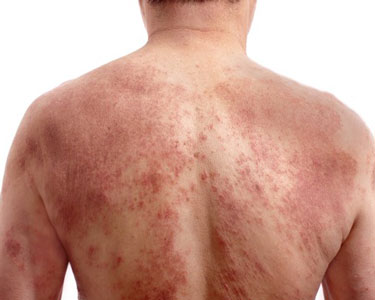
特应性皮炎(图片来源:icresearch.net)
2021年09月09日讯 /生物谷BIOON/ --辉瑞(Pfizer)近日宣布,英国药品和保健品管理局(MHRA)已批准Cibinqo(abrocitinib),该药是一种每日一次的口服JAK1抑制剂,用于治疗适合系统治疗、年龄在12岁及以上的中度至重度特应性皮炎(AD)青少年和成人患者。在英国,Cibinqo的推荐剂量为100mg或200mg。
值得一提的是,这是abrocitinib在全球范围内获得的首个监管批准。目前,abrocitinib的上市申请已提交至全球多个国家和地区进行审查,包括美国、澳大利亚、日本和欧盟。在多项临床试验中,abrocitinib在缓解AD症状和体征方面具有很强的疗效,包括迅速减轻瘙痒症状、清除皮损。特别是,在头对头3期JADE DARE(B7451050)研究中,与皮下注射制剂Dupixent(中文商品名:达必妥,通用名:度普利尤单抗,dupilumab)相比,abrocitinib在每一个评估的疗效指标上都具有统计学上的优越性。
在英国方面,去年,MHRA授予了abrocitinib有前途创新药物(PIM)称号。今年1月,MHRA针对abroctinib发布了一份积极的科学意见,支持通过早期获药计划(EAMS)为重度特应性皮炎患者提供治疗,具体为:需要接受系统疗法、并且对已批准的系统疗法应答不足或失应答、或不适合或不能耐受已上市系统疗法的患者。这使得医疗保健专业人员能够根据医疗需求显著未满足的患者的临床因素,在监管批准之前开具治疗处方。
Cibinqo的监管批准,基于来自强有力的3期JADE全球临床开发项目的数据。在该项目中,与安慰剂相比,abrocitinib在皮损清除、疾病范围和严重程度方面表现出了统计学上的优越性,而且瘙痒症状也得到了迅速改善(最早在第2周)。在AD临床研究中,共有3128名患者接受了Cibinqo治疗。有994名患者至少治疗48周。整合了5项安慰剂对照研究(703名患者服用100mg每日一次,684名患者服用200mg每日一次,438名患者服用安慰剂),以评估Cibinqo与安慰剂在长达16周内的安全性。
在安慰剂对照研究中,接受Cibinqo 200mg治疗的患者中最常见的不良反应(发生率≥2%)包括:恶心(15.1%)、头痛(7.9%)、痤疮(4.8%)、单纯疱疹(4.2%)、血肌酸磷酸激酶升高(3.8%)、呕吐(3.5%)、眩晕(3.4%)和腹痛(2.2%)。最常见的严重不良反应是感染(0.3%)。
辉瑞生物制药集团总裁Angela Hwang表示:“我们非常高兴MHRA批准abrocitinib治疗中重度特应性皮炎患者。这对于英国患有中重度疾病且需要创新治疗方案的患者来说是一项重要发展。在获得批准后,我们现在的首要任务是与NICE和苏格兰医药联合会(SMC)合作,确保药物的常规获取,以便中重度AD患者能够从这一重要疗法中获益。”
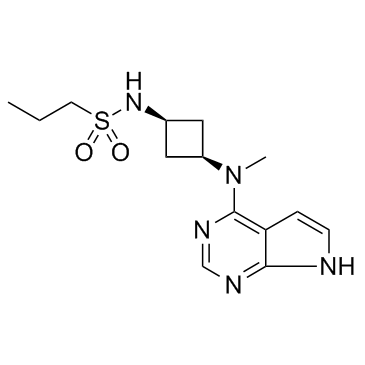
abrocitinib分子结构式(图片来源:medchemexpress.cn)
特应性皮炎(AD)是一种以皮肤炎症和皮肤屏障缺陷为特征的慢性皮肤病,其特征是皮肤红斑、瘙痒、硬化/丘疹形成、渗液/结痂。该病是一种严重的、不可预测的、通常会使人衰弱的皮肤疾病,会对患者及其家属的日常生活产生重大影响。AD是最常见的、慢性、复发性儿童皮肤病之一,影响全世界高达10%的成人和高达20%的儿童。许多中重度患者的病情控制不佳,需要额外的治疗方案来缓解对他们来说最重要的症状。
Cibinqo的活性药物成分abrocitinib是一种口服小分子,可选择性地抑制Janus激酶1(JAK1)。抑制JAK1被认为可调节多种参与特应性皮炎(AD)病理生理过程的细胞因子,包括白细胞介素(IL)-4、IL-13、IL-31、IL-22和胸腺基质淋巴细胞生成素(TSLP)。在美国,FDA于2018年2月授予了abrocitinib治疗中重度AD的突破性药物资格(BTD)。目前,abrocitinib(100mg,200mg)用于治疗年龄≥12岁中度至重度AD患者的新药申请(NDA)正在接受美国FDA的审查。此外,abrocitinib在同一患者群体中的营销授权申请(MAA)也正在接受欧洲药品管理局(EMA)的审查,预计将在2021年下半年获得审查结果。
今年8月,辉瑞公布了头对头3期JADE DARE(B7451050)研究的阳性结果。该研究在接受背景局部疗法的中度至重度AD成人患者中开展,将abrocitinib(200mg,口服,每日一次)与Dupixent(300mg,皮下注射,每2周一次)进行了直接对比。该研究中,abrocitinib以每日口服一次200mg片剂治疗,Dupixent在600mg诱导剂量后每隔一周皮下注射一次300mg剂量治疗,所有患者均接受背景外用疗法。
研究共同主要疗效终点是:(1)治疗第2周时实现瘙痒应答的患者比例,定义为峰值瘙痒数值评定量表(PP-NRS,评分范围:0-10)评分与基线相比改善≥4分;(2)治疗第4周时实现湿疹面积和严重程度指数-90(EASI-90)应答的患者比例,定义为EASI(评分范围:0-72)评分与基线相比改善≥90%。关键次要终点是治疗第16周时实现EASI-90应答的患者比例。该研究将允许评估在治疗第6个月时可能持续存在的任何疗效差异。
结果显示,该研究达到了共同主要疗效终点和关键次要疗效终点:与Dupixent相比,abrocitinib在每一个评估的疗效指标上都具有统计学上的优越性,并且其安全性与先前的研究一致。
Dupixent(达必妥®)由赛诺菲与再生元合作开发,是全球首个也是唯一获批治疗中重度特应性皮炎(AD)的靶向生物制剂,能快速、显著、持续地改善特应性皮炎患者的皮损程度和瘙痒症状。
Dupixent靶向2型炎症的关键驱动因素,该药是一种全人源化单克隆抗体,特异性抑制2种关键蛋白IL-4和IL-13的过度激活信号。IL-4/IL-13是2种炎症因子,是2型炎症疾病中内在炎症的关键和中心驱动因素。2型炎症在特应性皮炎、哮喘、慢性鼻-鼻窦炎伴鼻息肉(CRSwNP)、嗜酸细胞性食管炎等疾病中扮演重要角色。
Dupixent于2017年3月底上市,目前已获批治疗3种由2型炎症导致的疾病:中度至重度特应性皮炎(≥6岁患者)、中度至重度哮喘(≥12岁患者)、伴鼻息肉的慢性鼻-鼻窦炎(CRSwNP,成人患者)。
在中国,2020年6月,Dupixent(达必妥)获得国家药品监督管理局(NMPA)批准,用于治疗成人中重度特应性皮炎(AD)。达必妥是全球首个也是唯一获批治疗成人中重度特应性皮炎的靶向生物制剂,填补了国内临床未被满足的需求,能快速、显著、持续地改善特应性皮炎患者的皮损程度和瘙痒症状。得益于药监改革的推动,达必妥提前两年在中国获批,为中国患者提供了全新的治疗选择。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


