Science子刊论文解读!对AAV病毒载体进行改造以逃避先天免疫反应和炎症反应
来源:本站原创 2021-02-15 23:22
2021年2月15日讯/生物谷BIOON/---近年来,腺相关病毒(AAV)已被公认为治疗基因体内递送的主要载体,这是因为它是非致病性的,并且有效地靶向许多不同的细胞和组织类型。最近美国食品药品管理局(FDA)批准了基于AAV的基因替换疗法用于治疗脊髓肌肉萎缩和一种形式的遗传性视网膜营养不良,这突出了这种治疗方式的前景。体内基因疗法的一个关键挑战是它们可能会
2021年2月15日讯/生物谷BIOON/---近年来,腺相关病毒(AAV)已被公认为治疗基因体内递送的主要载体,这是因为它是非致病性的,并且有效地靶向许多不同的细胞和组织类型。最近美国食品药品管理局(FDA)批准了基于AAV的基因替换疗法用于治疗脊髓肌肉萎缩和一种形式的遗传性视网膜营养不良,这突出了这种治疗方式的前景。
体内基因疗法的一个关键挑战是它们可能会引起免疫反应和炎症,这可能会影响这类疗法的效果或持续时间,在极少数情况下甚至会危及生命。最近报道的3名儿童在治疗X连锁肌管病的临床试验中接受高剂量系统递送的AAV基因治疗后死亡的事件,这显著表明AAV介导的毒性和免疫反应尚未完全理解,目前的AAV递送载体仍需进一步改进。
AAV衣壳和基因组都可以作为免疫原性成分。具体来说,这种包含治疗基因的载体基因组可以激活一种称为Toll样受体9(TLR9)的蛋白。TLR9是一种所谓的模式识别受体,可以在专门的免疫细胞中检测外来DNA。这种检测首先会引发免疫反应,导致炎症(先天性免疫),随后针对AAV 衣壳的更特异性免疫反应(适应性免疫,以细胞毒性T细胞的形式),阻止这种疗法起作用,带来潜在风险。
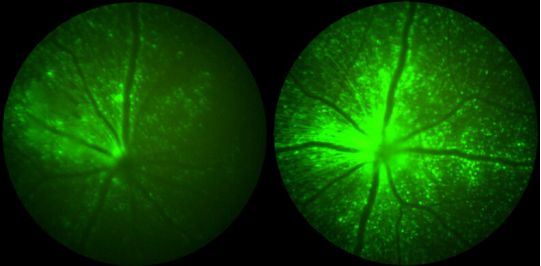
Science Translational Medicine, 2021, doi:10.1126/scitranslmed.abd3438。
如今,在一项新的研究中,美国哈佛大学韦斯生物启发工程研究所的George Church团队和哈佛医学院的Constance Cepko团队等人开发出一种“偶联免疫调节(coupled immunomodulation)”策略,在这种策略中,将短TLR9抑制序列直接整合到更长的含有治疗性DNA序列的AAV基因组中。在小鼠的不同组织以及猪和非人灵长类动物的眼部组织中进行了研究,该方法显示出广泛的抗免疫原性潜力。重要的是,这项研究还强调,在猕猴玻璃体腔内注射AAV的高免疫原性模型中,除了TLR9激活外,其他途径可能促进炎症。相关研究结果发表在2021年2月10日的Science Translational Medicine期刊上,论文标题为“Engineering adeno-associated viral vectors to evade innate immune and inflammatory responses”。
利用偶联免疫调节隐匿AAV
论文第一作者兼论文共同通讯作者Ying Kai Chan博士说,“我们推测,结合并抑制TLR9激活的小片段DNA,包括来自人类染色体末端称为端粒的DNA序列,当直接被整合到AAV基因组中时,将是一种让AAV基因组免受这种免疫监视机制影响的方法。”Chan博士之前是与Church合作的博士后研究员、Ally Therapeutics公司的首席科学官,如今哈佛大学韦斯生物启发工程研究所的访问学者。Chan和Church都是哈佛大学韦斯生物启发工程研究所基因治疗初创公司Ally Therapeutics的联合创始人。
这些研究人员首先构建出一系列合成的DNA“炎症抑制寡核苷酸(inflammation-inhibiting oligonucleotide, IO)”序列,每个序列都带有与不同的TLR9抑制序列相连接的高度炎症性的部分,并测试了这些IO序列对体外培养细胞的影响。TLR9抑制序列的存在使得炎症反应减弱了95%。与未修饰的载体相比,当通过直接串联整合到AAV载体时,这些IO序列抑制了原代人类免疫细胞中的先天免疫反应。
为了在体内测试AAV的策略,这些研究人员将AAV系统性或局部给送到小鼠的肌肉组织。缺乏IO序列的对照病毒诱导了肝脏中的抗病毒干扰素反应和先天性免疫细胞的浸润,并导致肌肉组织中细胞毒性T细胞的浸润和激活。这些效应在缺乏功能性TLR9通路的突变小鼠中不存在,这表明TLR9确实是AAV诱导的炎症的关键调节因子。重要的是,在接受基因组中含有IO序列的工程化AAV给送的小鼠中,这些效应受到阻断或大大降低,这种偶联免疫调节策略增强了这种病毒递送的治疗基因的表达,从而表明这种策略具有潜在的更高疗效。
研究眼睛中的偶联免疫调节方法
由于存在限制免疫细胞和免疫抑制因子进入的血液-视网膜屏障,眼睛通常被描述为免疫特权(immune-privileged)场所。然而,多个临床试验已经报道了在将治疗相关剂量的AAV递送眼内后出现眼内炎症,这表明了免疫特权的局限性。大多数基于AAV的眼部基因疗法都直接应用于视网膜(视网膜下注射)。AAV递送到眼睛的玻璃体腔(玻璃体腔内注射)是非常理想的,这是因为它将具有较小的侵入性,并可能允许靶向更多的细胞,但不幸的是,它可会引起高度炎症。
利用小鼠玻璃体腔内注射AAV病毒后的体内成像和免疫细胞表征技术,这些研究人员证实,与未修饰的AAV相比,这种病毒基因组中整入的IO序列降低了眼部的炎症和浸润性T细胞群体的数量。这进一步与这种载体编码的报告基因在视网膜中的表达量提升数倍相吻合。
接下来,这些研究人员在大型动物模型中研究了他们的偶联免疫调节策略,首先在猪中通过视网膜下注射,然后在猕猴中通过玻璃体腔内注射。论文共同作者、Cepko实验室医学生Sean Wang随后,“我们发现,该策略缓解了猪体内由对照AAV病毒引发的独特病理,包括高精尖视觉所必需的感光细胞的缩短。”他们还发现,包括小胶质细胞和T细胞在内的免疫细胞对视网膜感光层的浸润得到了实质性的拯救。
Wang说,“在通过玻璃体腔内注射工程化AAV和对照AAV的猕猴中,虽然我们看到偶联免疫调节方法延迟了对照病毒引发的临床葡萄膜炎症状,并使治疗基因的表达量增加了2倍,但遗憾的是这些免疫抑制作用并不明显。”此外,使用预防性全身免疫抑制也无法预防观察到的葡萄膜炎,这表明这种途径的免疫原性挑战更复杂。
Cepko说,“从AAV诱导的眼内毒副作用,以及对TLR9抑制序列和对类固醇的适度反应来看,这些结果表明导致注射部位毒副作用的机制不止一种。我们如今可以带着这种理解继续前进,并寻找更多的途径。”
Chan说,“每一种在临床上取得初步成功的新型治疗方式在广泛部署之前都必须努力解决新出现的问题,AAV基因疗法也不例外。我们的研究代表了开发更安全更有效的下一代AAV载体的关键一步。”
哈佛大学韦斯生物启发工程研究所创始主任Donald Ingber博士说,“哈佛大学韦斯生物启发工程研究所在合成生物学、视觉科学和基因治疗领域的一流专家之间发起的这一重要合作为AAV工程开辟了一个新的方向,最终可能通过靶向病毒基因组工程有助于让基因治疗变得更加安全和有效。”(生物谷 Bioon.com)
参考资料:
1.Ying Kai Chan et al. Engineering adeno-associated viral vectors to evade innate immune and inflammatory responses. Science Translational Medicine, 2021, doi:10.1126/scitranslmed.abd3438.
2.A new vision for AAV-delivered gene therapies
https://medicalxpress.com/news/2021-02-vision-aav-delivered-gene-therapies.html
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


