镰状细胞病(SCD)新药!治疗疾病根源的药物Oxbryta(voxelotor)欧盟进入审查,美国已上市!
来源:本站原创 2021-01-29 02:49
Oxbryta是首个被批准直接抑制镰状血红蛋白聚合的治疗药物,这是导致SCD红细胞镰状化和破坏的根本病因。

2021年01月29日/生物谷BIOON/--Global Blood Therapeutics(GBT)公司近日,欧洲药品管理局(EMA)已受理Oxbryta(voxelotor)的营销授权申请(MAA),并已启动标准审查程序。该MAA寻求EMA授予Oxbryta完全批准,用于治疗12岁及以上镰状细胞病(SCD)患者的溶血性贫血。之前,EMA已授予voxelotor治疗SCD的优先药物资格(PRIME)和孤儿药资格。
在美国监管方面,Oxbryta于2019年11月获得FDA加速批准,用于治疗≥12岁SCD儿童和成人患者的溶血性贫血。Oxbryta通过FDA的优先审查通道获得批准,从新药申请(NDA)被受理到最终批准仅仅用了2个多月时间。此前,FDA已授予voxelotor治疗SCD的突破性药物资格(BTD)、快速通道地位、孤儿药资格和罕见儿科疾病资格。作为美国FDA加速批准的一个条件,GBT将继续在HOPE-KIDS 2研究中调查Oxbryta,这是一项批准后验证性研究,使用经颅多普勒(TCD)血流速度来评估Oxbryta降低2-15岁儿童中风风险的能力。
Oxbryta是一种首创(first-in-class)、每日一次、口服药物,是首个被批准直接抑制镰状血红蛋白聚合的治疗药物。血红蛋白聚合是导致SCD红细胞镰状化和破坏的根本病因。镰状化过程会导致溶血性贫血(红细胞破坏导致血红蛋白水平降低),毛细血管和小血管阻塞,阻碍血液和氧气在全身的流动。组织和器官供氧减少可导致危及生命的并发症,包括中风和不可逆的器官损伤
Oxbryta的活性药物成为voxelotor(前称GBT440),通过增加血红蛋白对氧的亲和力发挥作用。由于氧合的镰刀血红蛋白不聚合,voxelotor能阻断聚合化及由此导致的红细胞镰状化和破坏。voxelotor可改善溶血性贫血和氧运输,并潜在地改变SCD的进程。
GBT总裁兼首席执行官Ted W.Love表示:“镰状细胞病(SCD)会对患者及其家属的生活造成毁灭性的影响,包括严重的危及生命的并发症,可导致器官损伤和早亡。尽管犹如巨大的需求,但目前在欧洲还没有一种获批的疗法有潜力改变这种疾病的病程。我们期待着与EMA合作,尽快将治疗SCD溶血性贫血的首个治疗方案带给欧洲的患者。”
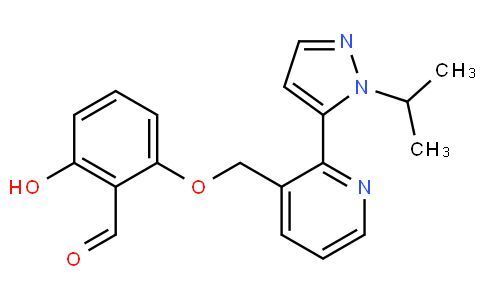
voxelotor分子结构式(图片来源:drugapprovalsint.com)
在欧洲,Oxbryta的营销授权申请(MAA)基于来自3期HOPE研究和2期HOPE-KIDS 1研究的数据,这2项研究都在欧洲的临床试验地点入组了患者。HOPE-KIDS 1是一项开放标签、单剂量和多剂量研究,评估了voxelotor治疗SCD儿科患者(4-17岁)的安全性、耐受性、药代动力学、探索性疗效。
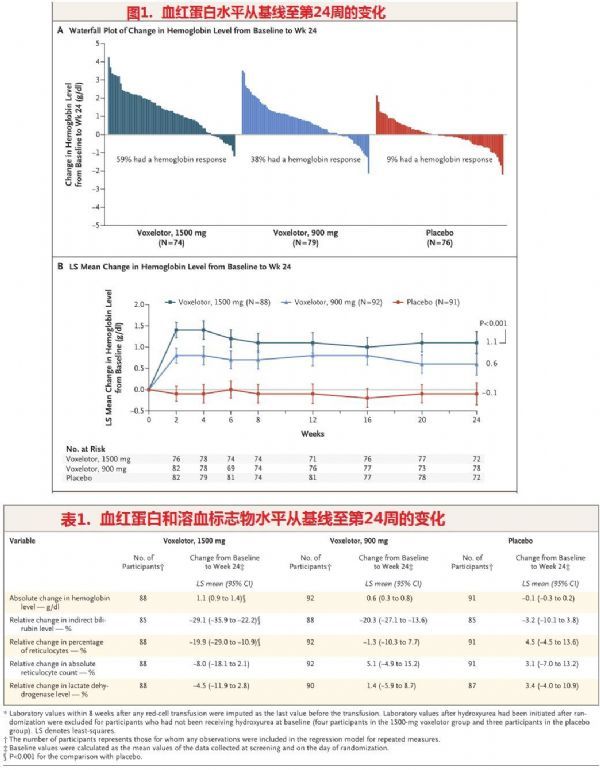
HOPE是一项随机、双盲、安慰剂对照3期研究,在全球22个国家60家研究机构开展,评估了2种剂量水平的voxelotor(1500mg和900mg,每日一次口服给药)与安慰剂治疗SCD的疗效和安全性。HOPE研究共入组了274例年龄在12岁及以上SCD患者,大部分患者患有镰状细胞贫血(纯合子血红蛋白S或血红蛋白Sβ0-地中海贫血),基线时约三分之二在接受羟基脲治疗。研究中,患者以1:1:1的比例随机分组,分别接受1500mg voxelotor、900mg voxelotor或安慰剂每日一次口服治疗。主要终点是在意向性治疗分析中,实现血红蛋白应答的患者比例,血红蛋白应答定义为第24周的血红蛋白相对基线增加超过1.0g/L。
结果显示,研究达到了主要终点:治疗第24周,与安慰剂相比,voxelotor显著增加了血红蛋白水平、降低了溶血生物标志物。这些结果与抑制HbS聚合相符,voxelotor表现出改善疾病的潜力。具体数据为:在意向治疗分析中,1500mg voxelotor治疗组(51%,95CI:41-61)产生血红蛋白应答的患者比例显著高于安慰剂组(7%,95%CI:1-12)。从基线至第24周,voxelotor各剂量组发生贫血恶化的患者数量均少于安慰剂组。此外,第24周时,1500mg voxelotor治疗组间接胆红素水平和网织红细胞百分比相对于基线的降幅显著超过安慰剂组。
HOPE研究中,voxelotor治疗组在24周期间报告的最常见副作用(发生在≥10%的患者中,且高出安慰剂组3%)为头痛(26% vs 22%)、腹泻(20% vs 10%)、腹痛(19% vs 13%)、恶心(17% vs 10%)、疲劳(14% vs 10%)、皮疹(14% vs 10%)和发热(12% vs 7%)。
对HOPE研究的完整数据的分析进一步证明,在12岁及以上的SCD患者中,每日一次1500mg剂量voxelotor在72周治疗期间可持久改善血红蛋白水平和溶血标记物。voxelotor治疗耐受性良好,未发现新的安全性或耐受性问题。HOPE研究的72周结果已在2020年12月举行的第62届美国血液学学会(ASH)年会上公布。

SCD(图片来源:nursingcrib.com)
镰状细胞病(SCD)是一种严重的、进行性的、使人衰弱的遗传性疾病,由β-珠蛋白基因突变导致异常镰状血红蛋白(HbS)的产生。HbS使红细胞变得病态和脆弱,导致慢性溶血性贫血、血管病变、难以捉摸的和痛苦的血管阻塞危象(VOC)。对于患有SCD的成人和儿童来说,这意味着痛苦的危机和其他改变生命或威胁生命的急性并发症,如急性胸腔综合征(ACS)、中风和感染。如果患者在急性并发症、血管病变和终末器官损害中存活,由此产生的并发症可导致肺动脉高压、肾功能衰竭和早期死亡。
作为首个治疗SCD疾病根源的药物,业界对Oxbryta的商业前景十分看好。医药市场调研机构EvaluatePharma此前发布报告预测,Oxbryta将成为全球最畅销的SCD药物,2024年销售额预计将达到19.8亿美元,来自蓝鸟生物的基因疗法Zynteglo/LentiGlobin在同期的销售额将达到10.33亿美元。

Zynteglo/LentiGlobin是一种一次性基因疗法,开发用于SCD和β地中海贫血的治疗。该药通过慢病毒载体将改良版本的β珠蛋白基因(βA-T87Q-珠蛋白基因)的功能拷贝在体外植入到从患者体内分离出的造血干细胞(HSC)中,再将这些细胞回输入患者体内,患者就拥有了βA-T87Q-珠蛋白基因,其红细胞就能够产生抗镰状血红蛋白HbAT87Q,降低异常镰状血红蛋白(HbS)的比例,从而减少镰状红血球、溶血等并发症。2020年9月,EMA授予了Zynteglo治疗SCD的优先药物资格(PRIME)。
监管方面,2019年6月,Zynteglo获欧盟有条件批准,用于12岁及以上、非β0/β0基因型的输血依赖性β地中海贫血(TDT)患者。此次批准,使Zynteglo成为全球治疗TDT的首个基因疗法。但行业人士认为,该药更大的市场机会存在于SCD治疗领域。(生物谷Bioon.com)
原文出处:European Medicines Agency Accepts GBT’s Marketing Authorization application (MAA) for Oxbryta (voxelotor) for the Treatment of Hemolytic Anemia in Sickle Cell Disease
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->