淋巴瘤新药!新一代口服PI3Kδ/CK1-ε双重抑制剂umbralisib获美国FDA优先审查!
来源:本站原创 2020-08-14 15:36
治疗复发/难治性边缘区淋巴(MZL)和滤泡性淋巴瘤(FL)的总缓解率为40-50%。

2020年08月14日讯 /生物谷BIOON/ --TG Therapeutics是一家致力于为B细胞介导的疾病患者开发创新疗法的生物制药公司。近日,该公司宣布,美国食品和药物管理局(FDA)已受理了umbralisib的新药申请(NDA),该药是一种口服磷酸肌醇-3-激酶δ(PI3K-δ)和酪蛋白激酶1-ε(CK1-ε)双重抑制剂,用于治疗:(1)已接受至少一种基于抗CD20方案的边缘区淋巴瘤(MZL)患者;(2)已接受过至少2种系统疗法的滤泡性淋巴瘤(FL)。此前,FDA已授予umbralisib治疗MZL的孤儿药资格(ODD)和突破性药物资格(BTD)。
MZL适应症申请根据BTD将进行优先审查,处方药用户收费法(PDUFA)目标日期为2021年2月15日。FL适应症申请将进行标准审查,PDUFA目标日期为2021年6月15日。FDA还通知该公司,目前不打算召开咨询委员会会议来讨论这一申请。
TG Therapeutics公司执行主席兼首席执行官MichaelS.Weiss表示:“我们非常高兴FDA受理了我们的首次NDA申请,并期待在审查过程中与FDA合作。这是我们在实现为B细胞疾病患者开发新疗法的目标的道路上取得的重大成就,我们相信umbralisib有潜力成为以前接受过治疗的MZL和FL患者的一个重要治疗选择。我们期待着在年底之前提供支持该NDA提交的UNITY-NHL试验的数据。”
umbralisib的NDA主要基于UNITY-NHL 2b期试验中umbralisib单药治疗MZL和FL队列的数据,评估治疗复发/难治性MZL或FL患者。该公司先前宣布,每个队列均达到其总缓解率(ORR)主要终点,达到了独立审查委员会(IRC)确认的40-50%的公司目标指导。
UNITY-NHL是一项多中心、开放标签2b期研究,MZL队列旨在评估umbralisib单药治疗先前接受过至少一种抗CD20方案的MZL患者;FL队列旨在评估umbralisib单药治疗先前接受过至少2种治疗方案(包括抗CD20方案和烷基化制剂)的FL患者;2个队列的主要终点均为IRC评估确定的总缓解率(ORR),目标指导为40-50%。
2019年2月,MZL队列数在主要终点ORR方面达到了40-50%的目标指导值:ORR为52%,其中完全缓解率(CR)为19%、部分缓解率(PR)为33%,疾病稳定率(SD)为36%。中位随访12.5个月时,中位缓解持续时间(DoR)尚未达到。额外的疗效数据包括:临床受益率88%、86%的患者肿瘤负担减少、治疗至缓解的中位时间为2.7个月、12个月无进展生存率为66%、中位无进展生存期尚未达到。研究中,umbralisib的耐受性和安全性良好。
2019年10月,TG公司宣布:FL队列达(n=118)的ORR主要终点结果达到了40-50%的目标指导值。重要的是,umbralisib单药治疗耐受性良好,安全性与之前报告的一致。详细数据将在未来召开的医学会议上公布。
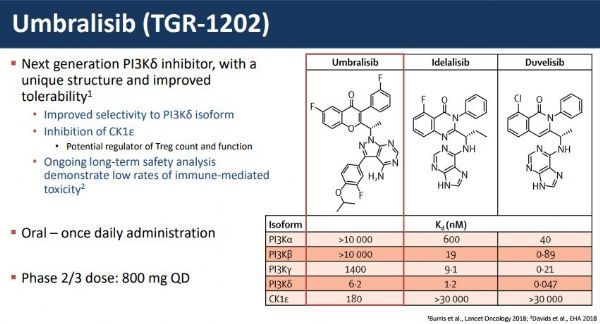
umbralisib是一种口服、每日一次的PI3Kδ和CK1-ε双效抑制剂,这可能使其克服第一代PI3Kδ抑制剂相关的某些耐受性问题。磷脂酰肌醇-3激酶(PI3K)是一类参与细胞增殖和存活、细胞分化、细胞内运输和免疫等多种细胞功能的酶。PI3K有四种亚型(α、β、δ和γ),其中δ亚型在造血来源的细胞中强烈表达,常与B细胞相关淋巴瘤有关。
umbrasib对PI3K的δ亚型具有纳米摩尔效力,并且对α、β、γ亚型具有高选择性。umbralisib还独特地抑制酪蛋白激酶1-ε(CK1-ε),这可能具有直接的抗癌作用,也可能调节先前PI3K抑制剂中观察到的与免疫介导不良事件相关的T细胞活性。
当前已批准的PI3Kδ抑制剂与自身免疫介导的毒性有关,如肝毒性、肺毒性和结肠炎。与已批准的PI3K抑制剂相比,umbralisib的特异性差异、其对CK1-ε的独特抑制作用以及其独特和专利的化学结构可能会在PI3K抑制剂类中具有差异化特征。
umbralisib已在血液系统恶性肿瘤的临床前模型和临床研究中证明了其活性。目前,在CLL和NHL患者中开展的IIb期和III期试验正在继续评估umbralisib的治疗潜力。
除了umbralisib之外,TG公司也正在开发一款单抗药物ublituximab(TG-1101),这是一种糖工程化嵌合IgG1单克隆抗体,靶向CD20,目前处于III期临床开发,评估治疗癌症(慢性淋巴细胞白血病[CLL]、非霍奇金淋巴瘤[NHL])和非癌症(多发性骨髓瘤[MM])适应症。
此外,TG公司还有多款资产进入了I期临床,包括PD-L1单抗TG-1501、共价结合布鲁顿酪氨酸激酶(BTK)抑制剂TG-1701等。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->