Science新发现!巨大噬菌体或拥有一种能进行理想基因编辑操作的迷你Cas蛋白—CasΦ蛋白!
来源:本站原创 2020-07-26 23:06
2020年7月27日 讯 /生物谷BIOON/ --近日,一篇刊登在国际杂志Science上题为“CRISPR-CasΦ from huge phages is a hypercompact genome editor”的研究报告中,来自加利福尼亚大学等机构的科学家们通过研究发现,巨大噬菌体(megaphages)或许拥有进行理想基因编辑的mini-Cas蛋
2020年7月27日 讯 /生物谷BIOON/ --近日,一篇刊登在国际杂志Science上题为“CRISPR-CasΦ from huge phages is a hypercompact genome editor”的研究报告中,来自加利福尼亚大学等机构的科学家们通过研究发现,巨大噬菌体(megaphages)或许拥有进行理想基因编辑的mini-Cas蛋白。
图片来源:Basem Al-Shayeb and Patrick Pausch, UC Berkeley
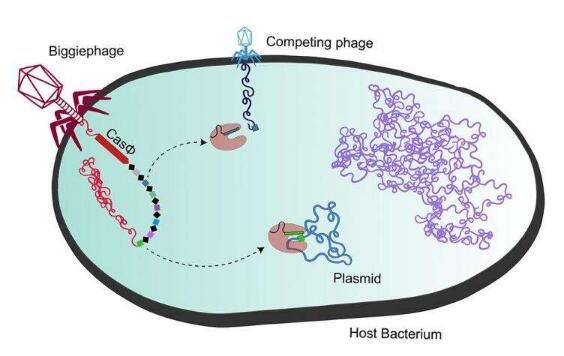
CRISPR-Cas9和其相关的基因编辑工具的核心DNA切割蛋白最初来自于细菌,但最新发现的多种Cas蛋白显然是在感染细菌的病毒中进化而来的;新的Cas蛋白是在已知最大的感染细菌的病毒(噬菌体)中发现的,同时其也是迄今为止发现的最紧凑的工作Cas突变体,其只有Cas9蛋白尺寸的一半左右。更小、更为紧凑的Cas蛋白往往更容易被运送到细胞中进行基因编辑,因为其能被装入较小的运输载体中,目前最流行的一种运输载体就是腺相关病毒(AAV),超级紧凑的Cas蛋白也能在AAV内部为其它额外的“货物”留出空间,作为目前已知的最小的Cas蛋白,研究者新发现的CasΦ(Cas-phi)在被运输到细胞中来操纵作物基因或治疗人类疾病时,其要比当前的基因编辑工具更加具有优势。
研究者Patrick Pausch说道,腺病毒是运输基因载体完美的特洛伊木马,其能非常容易地对病毒进行编程并使其到达身体几乎任何部位,但你智能将一个很小的Cas9装入这样的病毒中来对其进行运输,如果有另外一种相比Cas9而言更为紧凑的CRISPR-Cas系统,那么就有足够的空间来容纳其它额外的元件,不同的蛋白质就会融合到Cas蛋白、DNA修复模板或其它能调节Cas蛋白并控制基因编辑结果的因子中。很显然,这些巨大噬菌体能利用CasΦ蛋白来诱骗细菌去抵御病毒,而不是自己。
其实让研究人员专门研究这种蛋白的幸福在于,所有已知的CRISPR-Cas系统最初都是从细菌和古细菌中发现的,其能用来抵御病毒,但这次是唯一一次在病毒基因组中发现新型的CRISPR-Cas系统,这就会让研究者思索该系统到底有着什么样的不同,于是他们在实验室中发现了新型CRISPR-Cas系统的很多有趣的特性。在这些特性中,CasΦ能够进化地更具流线型,其能将多种功能结合到一种蛋白质中,因此就能省去Cas9一半的蛋白质片段,同时其与细菌中原始的Cas9酶一样,能够选择性地靶向作用特殊的DNA区域,而且效率同样很高,其在细菌、动物和植物细胞中都能发挥作用,而且是一种非常有前途、适用范围很广的基因编辑器。
研究者表示,本文研究表明,这种病毒编码的CRISPR-Cas蛋白实际上非常擅长它所做的事情,但其尺寸仅有Cas9的一半,这一点非常重要,因为其更容易被运输到细胞中;当研究者考虑未来CRISPR如何应用时,目前所面临的重要瓶颈之一就是运输,而这种由微小病毒所编码的CRISPR-Cas系统或许就是突破这一障碍的一个方法。研究者发现,巨大噬菌体往往拥有自身的Cas蛋白;去年研究者Banfield及其团队就通过研究发现了CasΦ蛋白,他表示,我们能利用宏基因组测序手段来发现多种环境中存在的细菌、古细菌和病毒,随后探索其基因目睹以便能理解这些有机体是如何在其群落中独立的以及如何在一起结合发挥作用。噬菌体中的CRISPR-Cas系统是病毒与其宿主之间相互作用非常有趣的一个方面。
虽然巨大噬菌体能帮助研究人员分离编码CasΦ蛋白的基因,但其序列只能告诉研究者,CasΦ仅仅是V型家族中的一种Cas蛋白,而其与其它V型Cas蛋白在进化上也存在一定距离,包括Cas12a、CasX和Cas14等,尽管目前研究者并不清楚是否其拥有抵御外来DNA的免疫系统功能,但目前研究表明,与Cas9相似,CasΦ能靶向切割细菌细胞中的外来基因组,同时还能切割人类胚胎肾细胞和拟南芥细胞中的双链DNA,同时其还要比Cas9能靶向作用更为广泛的DNA序列。CasΦ能切割双链的能力显然就是一个很大的优势,所有其他紧凑的Cas蛋白都会优先切割单链DNA,因此尽管其可能会整齐地融入诸如AAV这样紧凑型的运输系统中,但在细胞内编辑双链DNA时,其作用就会小很多。
最后研究者Pausch表示,正如Cas9的基因编辑能力在2012年首次被认可后一样,未来研究人员还有很大的空间去优化CasΦ,并发现能引导RNAs靶向作用特定基因的最佳规则。(生物谷Bioon.com)
参考资料:
【1】Megaphages harbor mini-Cas proteins ideal for gene editing
【2】Patrick Pausch, Basem Al-Shayeb, Ezra Bisom-Rapp, et al. CRISPR-CasΦ from huge phages is a hypercompact genome editor, Science 17 Jul 2020: Vol. 369, Issue 6501, pp. 333-337 doi:10.1126/science.abb1400
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


