Cell综述深度解读!基于CRISPR治疗性基因编辑领域的研究现状及未来展望!
来源:本站原创 2020-04-21 09:14
2020年4月21日 讯 /生物谷BIOON/ --日前,一项刊登在国际杂志Cell上题为“CRISPR-Based Therapeutic Genome Editing:Strategies and In Vivo Delivery by AAV Vectors”的综述文章中,来自马赛诸塞大学医学院等机构的科学家们描述了以CRISPR为基础的改善人类健康的
2020年4月21日 讯 /生物谷BIOON/ --日前,一项刊登在国际杂志Cell上题为“CRISPR-Based Therapeutic Genome Editing:Strategies and In Vivo Delivery by AAV Vectors”的综述文章中,来自马赛诸塞大学医学院等机构的科学家们描述了以CRISPR为基础的改善人类健康的策略,其重点是通过利用AAV载体将CRISPR疗法直接导入人体,此外,研究人员还讨论了目前广泛应用基于CRISPR疗法所要面临的挑战,并强调了持续的研究和技术革新对于推动基于CRISPR疗法在人类疾病研究中的重要性。
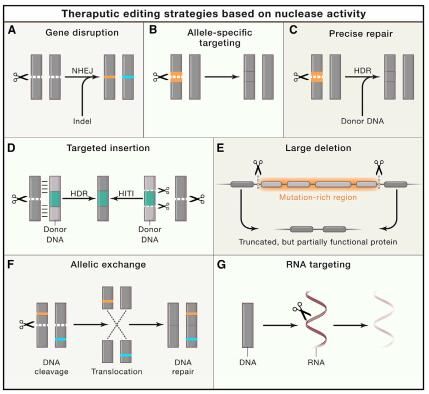
图片来源:Dan Wang,et al. Cell,doi:10.1016/j.cell.2020.03.023
目前应用基于CRISPR的治疗性手段能直接应用于患者体内,有望治疗多种人类疾病,尽管基于CRISPR的工具箱能够对DNA和RNA编辑及基因表达调节进行多种操作,但其药物的运输仍然是该疗法发展的瓶颈,目前,腺相关病毒(AAV)载体是进行体内基因治疗的主要载体;AAV非常安全,其能将单链DNA(ssDNA)载体基因组运输到多个组织和细胞类型中,而且仅在一定剂量范围内具有轻度的免疫原性;尽管载体基因组在宿主细胞内大部分处于游离状态,但通过共分化和环化来介导有丝分裂后细胞内长期的转基因表达,就能使其稳定下来并产生持久的治疗效果,AAV载体在运输基因疗法到疾病动物模型和患者中推动了基于CRISPR疗法在治疗多种疾病中的应用。
AAV-CRISPR疗法的进展也面临着AAV基因疗法发展中普遍存在的一系列障碍,比如预先存在的对AAV衣壳的免疫力及载体诱导的免疫反应、运输效率和特异性及AAV载体的开发等;此外,临床应用的AAV-CRISPR也提出了独特的挑战,其就需要独特的解决方案;在已有抗Cas9免疫存在的情况下,将定向Cas9蛋白直接运输到人体是否会降低其安全性或治疗效果,这仍然有待于进一步评估;解决免疫原性问题的潜在途径包括使用免疫正交Cas9标准且进一步探索CRISPR系统的自然多样性,从而识别可能对人类免疫原性较低的新酶;此外,多种蛋白质工程化方法也能够改善临床相关的特征,比如为了更好的免疫功能而绘制和编辑表位。
对于任何基因组编辑疗法都需要仔细评估脱靶编辑效应,近年来,科学家们开发出了多种方法来分析基于CRISPR试剂的脱靶特性;尽管这些方法在核酸序列水平上能提供对脱靶点的敏感性测定,但任何脱靶事件的潜在生物学后果在很大程度上都必须通过经验来进行评估;由于脱靶效应会严重依赖于物种特异性的基因组序列和体内给药的方式,因此,在细胞或组织水平下利用人源化动物模型就能够提供有价值的临床前信息,为了改善特异性,多种蛋白质工程学方法就能够产生高保真度的Cas和Cas效应融合蛋白。以CRISPR为基础治疗手段的其它组分,比如sgRNA和供体模板,就能够被修饰从而增强编辑的准确性和编辑效率。
除了脱靶编辑之外,目标编辑还会导致产生一些不希望发生的编辑事件,比如延伸到附近基因的大片段缺失、染色体重排(包括倒位和易位)及AAV载体基因组整合等;分析这些事件通常需要一系列不同于监测脱靶裂解的技术,而值得注意的是,治疗性的基因组编辑策略会协同编辑器的作用以及该编辑器所诱发的多种细胞过程,比如利用核酸酶活性的情况下进行的DNA损伤修复,因此,更好地理解相关细胞过程或能为改善基因组编辑的安全性提供更多宝贵的见解。
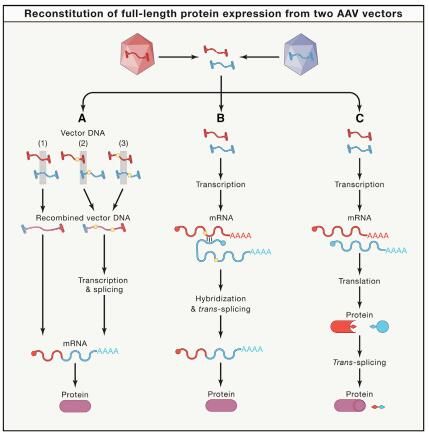
图片来源:Dan Wang,et al. Cell,doi:10.1016/j.cell.2020.03.023
疾病动物模型是转化研究和疗法开发中的关键,由于体内递送是AAV-CRISPR疗法的主要瓶颈,因此直接在疾病动物模型中进行检测是评估疗法有效性的金标准,由于AAV基因替代疗法旨在运输功能性的基因拷贝来纠正引发疾病的基因拷贝,因此由多种基因敲除策略所建立的动物模型通常情况下是足够的。相比之下,诸如碱基编辑(base editing)和prime编辑(prime editing)等多种基因组编辑策略通常会靶向作用特定的突变,因此携带有意设计工程化突变的动物模型就需要提供一个合适的检测凭条,比如,研究人员会开发出携带代表性肌营养不良蛋白基因(dystrophin gene)突变的多个DMD小鼠模型来阐明多种基因编辑疗法的有效性;尽管基于CRISPR基因编辑技术的出现极大地促进了遗传性修饰动物的产生,但由于缺乏携带患者相关基因突变的适合动物模型,这对于科学家们而言仍然是一大挑战,而开发简单、强大且快速的动物模型方法或许就会加速精准基因编辑策略的开发。
CRISPR和AAV仅仅是阐明人类能够利用自然系统来开发革命性生物技术的两个例子,其凸显了对自然多样性理解和欣赏给科学家们带来的机遇,然而对微生物机体进行适应性改造来满足人类的需求并不能保证一定会成功;这个适应过程涉及多个跨学科的研究领域,比如微生物学、生物化学、分子生物学、蛋白工程学、结构生物学和生物信息学等,对于基于CRISPR的技术而言,其设计和利用的简单性并不应该掩盖共享有价值资源和技术的重要性,比如从质粒到sgRNA文库,再到转基因动物和生物信息学工具等,其能够鼓励科学家们进行交叉验证并快速采用该技术进行新的应用,同时也能够促进科学家们继续快速进行科学研究。
一般而言,运输是阻碍体内基因疗法最主要的障碍之一,包括基因编辑治疗性手段;AAV载体是目前最有效的基因运输工具,同时其也是被批准能将基于CRISPR的基因编辑疗法直接运输到人类体内的唯一一个运输载体。关于目前正在进行的AAV-CRISPR临床试验并对这些方法的优缺点进行分析将会是非常让人激动的,这种改进预计会来自于对基于CRISPR试剂进行修饰以适应AAV载体的内在特性,以及目前正在进行的AAV生物学和矢量学研究,将这两个领域的研究成果进行合并或有望产生一个更为广泛的传递平台,从而使其更好地服务于新型的分子疗法中。(生物谷Bioon.com)
参考资料:
Dan Wang, Feng Zhang, Guangping Gao. CRISPR-Based Therapeutic Genome Editing: Strategies and In Vivo Delivery by AAV Vectors, Cell, 2 April 2020, Pages 136-150, doi:10.1016/j.cell.2020.03.023
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


