造血干细胞研究进展(第6期)
来源:本站原创 2020-03-31 23:58
2020年3月31日讯/生物谷BIOON/---造血干细胞(hemapoietic stem cell, HSC)是存在于造血组织中的一群原始造血细胞,它不是组织固定细胞,可存在于造血组织及血液中。造血干细胞在人胚胎2周时可出现于卵黄囊,妊娠5个月后,骨髓开始造血,出生后骨髓成为干细胞的主要来源。在造血组织中,所占比例甚少。现代医学中,造血干细胞在骨髓移植和
2020年3月31日讯/生物谷BIOON/---造血干细胞(hemapoietic stem cell, HSC)是存在于造血组织中的一群原始造血细胞,它不是组织固定细胞,可存在于造血组织及血液中。造血干细胞在人胚胎2周时可出现于卵黄囊,妊娠5个月后,骨髓开始造血,出生后骨髓成为干细胞的主要来源。在造血组织中,所占比例甚少。现代医学中,造血干细胞在骨髓移植和疾病治疗方面有重要作用。
1988年法国的Gluckman教授在国际上率先成功采用脐血造血干细胞移植,救治了一名贫血患儿,标志着脐带血造血干细胞移植时代的开启。全球现每年约进行6万例骨髓移植术,其中使用自体和同种异体造血干细胞完成骨髓移植术的患者人数分别为近3.5万和2.5万例。
造血干细胞的来源主要包括骨髓、外周血和脐带血。如今,“骨髓移植”已渐渐被“外周血造血干细胞移植”代替。也就是说,现在捐赠骨髓已不再抽取骨髓,而只是“献血”了。 脐带血是胎儿娩出断脐后残留在脐带和胎盘中的血液,富含造血干细胞,可用于治疗急、慢性白血病和某些恶性肿瘤等多种重大疾病。
基于此,小编针对近年来造血干细胞研究取得的进展进行一番梳理,以飨读者。
1.Cell Stem Cell:造血干细胞通过保持对以前感染的记忆来提高免疫反应
doi:10.1016/j.stem.2020.01.017
在一项新的研究中,来自法国、德国和以色列的研究人员发现造血干细胞的一个令人吃惊的特性:它们不仅确保血细胞的持续更新,而且还能够记住以前的感染经历,从而在未来引发更快更有效的免疫反应。这些发现应当对未来的疫苗接种策略产生重大影响,并且为表现不佳或反应过度的免疫系统开发新疗法铺平道路。相关研究结果近期发表在Cell Stem Cell期刊上,论文标题为“C/EBPβ-Dependent Epigenetic Memory Induces Trained Immunity in Hematopoietic Stem Cells”。论文通讯作者为Michael Sieweke博士和Sandrine Sarrazin博士。
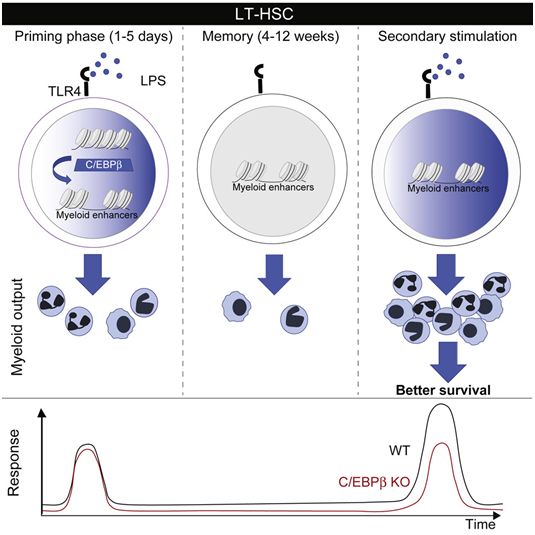
直到十年前,普遍流行的观点是HSC是非特化细胞,对诸如感染之类的外部信号视而不见。只有它们的特化子细胞才能感知这些信号并激活免疫反应。但是Sieweke实验室和其他实验室在过去几年的研究工作已证实了这种观点是错误的,并表明HSC实际上可以感知外部因素,以“按需”特异性产生抵抗感染的免疫细胞亚型。除了它们在紧急免疫反应中的作用外,HSC在应对反复感染事件中的功能仍是未知的。已知免疫系统具有记忆功能,这允许它更好地应对再次入侵的传染原。如今,这项新的研究确立了HSC在这种记忆中的核心作用。
Sarrazin说,“我们发现,如果HSC以前暴露于脂多糖(一种模拟感染的细菌分子),那么它们可以促进更快更有效的免疫反应。”Sieweke解释了他们如何发现这种记忆存储在这些干细胞中:“首次暴露于脂多糖会导致一些标记在HSC的DNA上堆积,而且就堆积在对免疫反应至关重要的基因周围。DNA上的这些标记就像书签一样,可以确保当再次遭受相同病原体感染时,这些基因容易被找到、访问和激活以快速产生反应。”
这些作者进一步探索了记忆是如何刻在DNA上的,并发现C/EBPb在其中起着重要作用,描述了这种因子的新功能,此外,该功能对于紧急免疫反应也很重要。总之,这些发现应当有助于改善对免疫系统的调节或开发更好的疫苗接种策略。
2.Science:研究表明阳性选择是造血的主要驱动力
doi:10.1126/science.aay9333
近日,剑桥大学,斯坦福大学和华盛顿大学医学院的一组研究人员发现了新的证据,表明阳性选择是塑造克隆性造血(clonal hematopoiesis)能力的主要驱动力。在《Science》杂志上发表的论文中,作者描述了他们对克隆性造血功能的研究以及他们从中学到的知识。
包括人类在内的有机体通过不断的细胞分裂而得以存活,这也是人体部位不断恢复活力的方式。但有时在分裂的过程中会产生突变,一些突变则是进化的驱动力,而其它一些突变可能对机体有害。先前的研究发现,随着时间的流逝,年龄的增长,可能会产生突变,这可能是有益的,也可能不是有益的。然而,科学家们至今仍未完全理解细胞分裂产生的突变的生物学意义。
先前的研究表明,克隆性造血是一种常见的与年龄相关的现象,其中血液中的造血干细胞或其他祖细胞参与形成与常规血细胞遗传上不同的血细胞群体。此外,某些突变可能是良性的,但已发现其他一些突变会引发癌前病变。这项新工作的研究人员试图了解有关此过程的更多信息。
这项工作涉及分析来自9个公共数据库的有关50,000多名癌症患者的血液肿瘤数据的信息。他们针对每个样本的变异等位基因频率(VAF)进行了编目分类。然后,他们使用数据建立了代表造血干细胞动力学的随机分支模型。除其他外,他们的模型显示中性突变要么很快灭绝,要么生长缓慢,并保持较低的VAF值。而且还表明,有益突变呈指数增长。综上所述,该模型表明,对有益突变的积极选择(而不是遗传漂移)决定了血液的遗传多样性。
3.Nat Commun:揭示有望帮助开发新型血液癌症疗法的新型信号通路
doi:10.1038/s41467-020-14478-8
近日,一项刊登在国际杂志Nature Communications上的研究报告中,来自Hackensack Meridian健康中心的科学家们通过研究发现,逆转骨髓中失控的炎症或有望帮助开发治疗某些血液癌症的新型疗法。文章中,研究者揭示了血管内皮细胞如何调节骨髓微环境中的炎性压力。
文章中,研究者揭示了两种参与骨髓抑制损伤(就像化疗所引发的)的关联通路的功能,在这种状况下,骨髓的活性会被降低,从而导致血细胞产量减少;骨髓抑制会导致促分裂原活化蛋白激酶(MAPK)通路的慢性激活,从而引发局部和系统性炎症,其反过来又受到了NF-kB信号通路的驱动作用;这种慢性炎症会干扰血管的完整性及造血干细胞的功能缺陷。
利用遗传模型来阻断NF-kB依赖性的内皮细胞炎症,研究人员发现了一种名为SCGFa(干细胞生长因子α,Stem Cell Growth Factor Alpha)的新型蛋白,当在骨髓抑制疗法(诸如化疗)后注入SCGFa蛋白或能维持血管功能,促进造血功能恢复及改善造血干细胞的功能,此外科学家们还能通过给予SCGFa来抑制血管和造血炎症,从而促进机体炎症后的恢复过程。
研究者Pradeep Ramalingam表示,我们发现,SCGFa能作为治疗用途使用,其能促进骨髓抑制后机体重要系统功能的恢复;由于老年人无法像年轻人一样经历过多的化疗,其在接受癌症治疗时往往表现较差,从而就会导致骨髓抑制性损伤的发生;如果给患者输注SCGFa,或许就能保护其机体的造血系统并促进其骨髓的快速再生和更新,这就能够给予患者更多的化疗,最终改善患者的预后并降低其疾病复发率。
4.Cell Stem Cell:造血干细胞有助于提高骨髓移植效率
doi:10.1016/j.stem.2020.01.013
根据2月27日发表在《Cell Stem Cell》杂志上的一项研究,西奈山的研究人员发现了一种增强造血干细胞效力的方法,这可能为新的骨髓移植方法打开了大门。
骨髓移植可以治愈许多血液疾病和实体瘤,而造血干细胞的稀缺严重限制了骨髓移植。西奈山研究小组的报告称,通过调控溶酶体周围的代谢活性,可以使造血干细胞在骨髓移植中的功效提高90倍以上。
“造血干细胞一旦在培养皿中培养,就会失去干细胞潜能,这限制了它们在实验室培养中易于繁殖的能力,”医学发展与再生生物学教授Saghi Ghaffari说道“为了使这些干细胞保持最佳效能,它们不应该时刻处于分裂状态,而是应处于休眠或静止状态。溶酶体是这些细胞休眠的关键。我们进一步了解到,抑制溶酶体活性可增强干细胞的静止性和效力,并可能具有治疗价值。”
通过在小鼠中进行研究,西奈山的科学家使用了有效而又特异的溶酶体抑制剂,可降低溶酶体的酸度和细胞中氨基酸的释放。最终结果是将具有活化溶酶体的干细胞恢复到静止状态。这项研究进一步发现,抑制糖酵解反应还可以增强造血干细胞的静止性和分裂潜力。
5.Nature:科学家成功实现原始造血干祖细胞的活体动物成像
doi:10.1038/s41586-020-1971-z
近日,一项刊登在国际杂志Nature上题为“Live-animal imaging of native haematopoietic stem and progenitor cells”的研究报告中,来自哈佛大学等机构的科学家们通过研究在活体动物中对原始的造血干祖细胞(native haematopoietic stem and progenitor cells)成功进行了成像研究。
当前,造血干细胞(HSCs,haematopoietic stem cells)的生物学研究主要是在移植条件下进行的,因此,对于科学家们而言,研究造血干细胞的行为就显得极具挑战,据研究者所知,目前研究人员尚未在活体动物的天然生境中实现对造血干细胞的可视化研究。这项研究中,研究人员就描述了一种双重的遗传性策略,其能将报告基因标记限定到最安静的长期造血干细胞(LT-HSCs)的亚群中,并且其能与当前头颅骨髓的活体成像方法相互兼容。
研究者表示,LT-HSCs的亚群既能靠近窦状血管又能靠近血管内皮表面,相比之下,多潜能祖细胞(MPPs,multipotent progenitor cells)与内皮细胞的距离变化更大,且其更有可能与过渡区血管相关联;LT-HSCs并不存在于最深处缺氧的骨髓生境中,而且会在类似于MPPs的缺氧环境中被发现。体内延时成像结果显示,LT-HSCs在稳定状态下的运动能力非常有限,而被激活的LT-HSCs则会表现出一些异质性反应,一些细胞会变得高度活跃,一小部分HSCs则会在空间受限的区域内呈现无性扩张状态;研究者表示,这些区域具有明确的特征,因为HSC的扩张几乎只会在具有骨骼重建活性的骨髓腔亚群中被发现,而相比较之下,具有较低骨吸收活性的腔体并不存在扩张的HSCs。
6.Nat Med:临床试验表明造血干细胞基因疗法有望治疗X连锁慢性肉芽肿病
doi:10.1038/s41591-019-0735-5
X连锁慢性肉芽肿病(X-linked chronic granulomatous disease, X-CGD)是一种罕见的遗传性血液疾病。它可导致反复感染、延长住院治疗时间和缩短寿命。在此之前,X-CGD患者不得不依赖骨髓捐献来获得病情缓解的机会。
在一项新的研究中,来自英国、美国、法国和德国的研究人员报道使用干细胞基因疗法治疗9名X-CGD患者:其中的6名患者目前病情缓解,并且停止了其他治疗。相关研究结果于2020年1月27日在线发表在Nature Medicine期刊上,论文标题为“Lentiviral gene therapy for X-linked chronic granulomatous disease”。
论文共同通讯作者、美国加州大学旧金山分校伊莱和伊迪特-布罗德再生医学与干细胞研究中心(Eli and Edythe Broad Center of Regeneration Medicine and Stem Cell Research)的Donald Kohn博士说,“通过这种基因疗法,你能够使用患者自己的干细胞替代供者细胞用于移植。这意味着这些细胞与患者完全匹配,它应当是一种更加安全的移植方法,没有产生免疫排斥的风险。”
7.Science子刊:供者造血干细胞中的罕见有害突变可能给受者带来健康问题
doi:10.1126/scitranslmed.aax6249
造血干细胞移植,也称为骨髓移植,是治疗急性髓细胞白血病(AML)等血液癌症的常见方法。这种治疗可以治愈血液癌症,但也可能导致危及生命的并发症,包括心脏问题和移植物抗宿主病。在移植物抗宿主病中,来自供者的新免疫细胞会攻击患者的健康组织。
在一项新的研究中,来自美国华盛顿大学医学院等研究机构的研究人员指出在健康供者的造血干细胞中存在的极其罕见的有害基因突变,尽管不会对供者造成健康问题,但是可能会传递给接受造血干细胞移植的癌症患者。在移植前患者接受放疗和化疗以及服用免疫抑制剂使得携带这些罕见突变的造血干细胞有机会快速地增殖,从而给接受造血干细胞移植的患者带来健康问题,比如心脏损伤、移植物抗宿主病和可能的新白血病。相关研究结果发表在2020年1月15日的Science Translational Medicine期刊上,论文标题为“Engraftment of rare, pathogenic donor hematopoietic mutations in unrelated hematopoietic stem cell transplantation”。
这项涉及AML患者及其造血干细胞供者样本的研究表明这些罕见的有害突变存在于非常年轻的供者中,可给受者带来健康问题,即使这些突变非常罕见以致于利用传统基因组测序技术无法在供者中检测到,也会如此。这些研究结果为在更多的健康供者中探究这些罕见突变的更大型研究打开了大门,从而可能导致人们开发出方法来阻止或减轻这类遗传错误给接受造血干细胞移植的患者带来的健康问题。
8.Stem Cell Rep:癌症研究帮助开发有用的造血干细胞
doi:10.1016/j.stemcr.2019.12.009
在超过25年的时间里,大量的研究工作试图使个性化的血液干细胞用于治疗白血病以及许多其他类型疾病。研究人员采取的一种方法是采集患者的成年细胞,然后对其进行“解码”,以产生诱导性多能干细胞(iPSC),该干细胞能够形成人体的任何细胞类型,包括血细胞在内。不幸的是,这些iPSC也有可能发育成癌细胞。因此研究人员将工作重心重新集中在制造造血干细胞(HSC)上,造血干细胞不能制造任何类型的细胞,但可以产生多种类型的血细胞。好消息是,HSC似乎不会像iPSC一样引起癌症。坏消息是研究人员无法创建可以在体内保持生长的HSC。
现在,科罗拉多大学癌症中心的一项研究介绍了一种诱导HSC产生的新方法。“我的实验室正在研究一种名为MLL的基因,当该基因与另一种基因意外融合时,会导致儿童白血病的发生。” CU癌症中心研究人员兼CU医学院儿科学系教授Patricia Ernst博士说。换句话说,MLL基因的功能失常是有害的,恩斯特则希望找到使这种致癌融合基因的功能失活的方法。但是要了解如何应对功能失常的MLL,Ernst和她的团队需要了解正常情况下MLL的工作原理。
Ernst的研究表明,多能干细胞中常规MLL蛋白的过表达可以推动这些细胞产生更多的血细胞。该发现可能有助于开发有用的HSC,从而可以在化疗和放疗后使白血病患者的血液系统再生。相关结果发表在最近的《Stem Cell Reports》杂志上。
9.Nature:重磅!科学家鉴别出能控制人类血液干细胞自我更新的特殊蛋白!
doi:10.1038/s41586-019-1790-2
近日,一项刊登在国际杂志Nature上的研究报告中,来自加利福尼亚大学的科学家们通过研究发现了一种特殊蛋白和人类学学干细胞自我更新能力之间的关联,研究者表示,激活该蛋白或能促进血液干细胞在实验室条件下自我更新至少12倍。在体外条件下增殖血液干细胞往往能极大地改善血液癌症(比如白血病)和多种遗传性血液疾病的治疗选择。
研究者发现,MLLT3基因的表达与血液干细胞自我更新的潜能密切相关,MLLT3基因所表达的蛋白能为血液干细胞提供必要的指令来使其能够维持自我更新的能力,其能通过与其它调节性蛋白协同作用来保持血液干细胞的重要部分在细胞分类时能正常发挥作用。研究者想知道是否在实验室培养皿中维持血液干细胞中MLLT3蛋白的水平就足以改善其自我更新的能力,利用一种病毒载体,研究人员就能将活性的MLLT3基因插入到血液干细胞中,同时他们观察到,功能性的血液干细胞会在实验室培养皿中的繁殖速率增长了至少12倍。
后期研究人员还将继续深入研究确定哪些特殊蛋白和血液干细胞DNA中的哪些元件会影响MLLT3基因的开关,以及如何在实验室培养皿中利用特殊制剂来控制这一过程,研究者有信心开发出新型策略,在不使用病毒载体的情况下开启/关闭MLLT3基因的表达,以便其能在临床条件下安全使用。
10.Nat Cell Biol:胚胎晚期以及青年阶段会出现造血干细胞的“波动性”产生
doi:10.1038/s41556-019-0410-6
近日,来自Hubrecht Institute等机构的研究人员发现,晚期胎儿和年轻人的骨髓中会出现了以前从未被发现到的“造血波动”现象。这种短暂的造血过程填补胚胎血液生产结束与成年骨髓造血开始两者之间的空白。相关结果于11月4日发表在《Nature Cell Biology》杂志上。
胚胎发育过程中的第一批HSC是通过内皮细胞向造血系统的转化而产生的,这一过程被称为“endothelial to hematopoietic transition(EHT)”。在脊椎动物的胚胎发育过程中,EHT在主动脉中短暂地出现。HSC数量会扩增,然后再迁移到骨髓组织中直到成年。迄今为止,我们尚不清楚EHT是否在胚胎期之后仍会发生,如果有的话,具体的发生地点又在何处?
为了查明EHT的发生机制,研究人员结合实验胚胎学,遗传学,转录组学和功能学等方法,通过鸡和小鼠模型进行研究。通过荧光基因标记和实时成像分析追踪形成骨髓的内皮细胞,他们发现骨髓的整个血管网络都来自一种叫做“体节”的组织。体节构成机体的“片段”,随着胚胎的发展,这些部分将逐渐形成生物体的重要组织,包括骨骼,肌肉和皮肤。出乎意料的是,研究人员发现,某些迄今仅在胚胎中观察到的内皮祖细胞,通过同样的EHT过程在胎儿晚期和成年骨髓中产生了HSCs和多能祖细胞。这些细胞与传统意义上的HSC的细胞非常相似,具有明显的Notch信号,以及表达EHT特异性的内皮组织相关基因和转录因子。因此,结果表明,HSC同样能够在胚胎期后产生,这与胚胎中的发生机制相同。
11.NEJM:世界首例!中国科学家找到治疗艾滋病和白血病新方法!
doi:10.1056/NEJMoa1817426
近日,一项刊登在国际杂志The New England Journal of Medicine上的研究报告中,来自北京大学-清华大学生命科学联合中心邓宏魁研究组、解放军总医院第五医学中心陈虎研究组及首都医科大学附属北京佑安医院吴昊研究组的研究人员通过联合研究发表了题为“CRISPR-Edited Stem Cells in a Patient with HIV and Acute Lymphocytic Leukemia”(利用CRISPR基因编辑的成体造血干细胞在患有艾滋病合并急性淋巴细胞白血病患者中的长期重建)的研究论文,这项研究成果标志着世界上首例通过基因编辑干细胞治疗艾滋病和白血病患者的案例由我国科学家成功完成了!

我们都知道,如今CRISPR-Cas9基因编辑工具对哺乳动物细胞的基因组进行编辑已经被广泛使用了,该技术展现出了潜在的临床使用前途,而且目前研究人员已经开始利用该技术来探寻基于CRISPR的疗法治疗人类疾病的安全性和可行性。CCR5是HIV-1感染人体的一个保护性靶点,CCR5缺失的血细胞常常对HIV-1的感染有很大的抵抗力;有研究表明,当将携带天然CCR5突变的造血干细胞和祖细胞(HSPCs,hematopoietic stem and progenitor cells,造血干祖细胞)进行同种异体移植后(allogeneic transplantation)就能长期根除HIV-1,因为CCR5是HIV进入机体的关键共受体,这些事例或许就增加了一种可能性,即移植携带人工破坏CCR5的细胞或能作为一种新方法来制造对HIV-1感染耐受的细胞。
中国科学家的这项最新研究描述了同种异体干细胞移植后CCR5 CRISPR基因编辑的CD34+细胞的长期移植状况,其对循环骨髓细胞基因组的基因干扰比率不到8%,而且并不存在基因编辑的脱靶效应。这项长达多年的工作目前已经初步证实了基因编辑造血干细胞在临床应用中的可行性与安全性,未来将会促进和推动该技术的临床应用。未来研究人员将会继续深入研究通过各种方法来优化基因编辑造血干细胞移植方案,从而降低脱靶率,实现100%的CCR5的敲除效率。(生物谷 Bioon.com)
1988年法国的Gluckman教授在国际上率先成功采用脐血造血干细胞移植,救治了一名贫血患儿,标志着脐带血造血干细胞移植时代的开启。全球现每年约进行6万例骨髓移植术,其中使用自体和同种异体造血干细胞完成骨髓移植术的患者人数分别为近3.5万和2.5万例。
造血干细胞的来源主要包括骨髓、外周血和脐带血。如今,“骨髓移植”已渐渐被“外周血造血干细胞移植”代替。也就是说,现在捐赠骨髓已不再抽取骨髓,而只是“献血”了。 脐带血是胎儿娩出断脐后残留在脐带和胎盘中的血液,富含造血干细胞,可用于治疗急、慢性白血病和某些恶性肿瘤等多种重大疾病。
基于此,小编针对近年来造血干细胞研究取得的进展进行一番梳理,以飨读者。
1.Cell Stem Cell:造血干细胞通过保持对以前感染的记忆来提高免疫反应
doi:10.1016/j.stem.2020.01.017
在一项新的研究中,来自法国、德国和以色列的研究人员发现造血干细胞的一个令人吃惊的特性:它们不仅确保血细胞的持续更新,而且还能够记住以前的感染经历,从而在未来引发更快更有效的免疫反应。这些发现应当对未来的疫苗接种策略产生重大影响,并且为表现不佳或反应过度的免疫系统开发新疗法铺平道路。相关研究结果近期发表在Cell Stem Cell期刊上,论文标题为“C/EBPβ-Dependent Epigenetic Memory Induces Trained Immunity in Hematopoietic Stem Cells”。论文通讯作者为Michael Sieweke博士和Sandrine Sarrazin博士。

图片来自Cell Stem Cell, 2020, doi:10.1016/j.stem.2020.01.017。
直到十年前,普遍流行的观点是HSC是非特化细胞,对诸如感染之类的外部信号视而不见。只有它们的特化子细胞才能感知这些信号并激活免疫反应。但是Sieweke实验室和其他实验室在过去几年的研究工作已证实了这种观点是错误的,并表明HSC实际上可以感知外部因素,以“按需”特异性产生抵抗感染的免疫细胞亚型。除了它们在紧急免疫反应中的作用外,HSC在应对反复感染事件中的功能仍是未知的。已知免疫系统具有记忆功能,这允许它更好地应对再次入侵的传染原。如今,这项新的研究确立了HSC在这种记忆中的核心作用。
Sarrazin说,“我们发现,如果HSC以前暴露于脂多糖(一种模拟感染的细菌分子),那么它们可以促进更快更有效的免疫反应。”Sieweke解释了他们如何发现这种记忆存储在这些干细胞中:“首次暴露于脂多糖会导致一些标记在HSC的DNA上堆积,而且就堆积在对免疫反应至关重要的基因周围。DNA上的这些标记就像书签一样,可以确保当再次遭受相同病原体感染时,这些基因容易被找到、访问和激活以快速产生反应。”
这些作者进一步探索了记忆是如何刻在DNA上的,并发现C/EBPb在其中起着重要作用,描述了这种因子的新功能,此外,该功能对于紧急免疫反应也很重要。总之,这些发现应当有助于改善对免疫系统的调节或开发更好的疫苗接种策略。
2.Science:研究表明阳性选择是造血的主要驱动力
doi:10.1126/science.aay9333
近日,剑桥大学,斯坦福大学和华盛顿大学医学院的一组研究人员发现了新的证据,表明阳性选择是塑造克隆性造血(clonal hematopoiesis)能力的主要驱动力。在《Science》杂志上发表的论文中,作者描述了他们对克隆性造血功能的研究以及他们从中学到的知识。
包括人类在内的有机体通过不断的细胞分裂而得以存活,这也是人体部位不断恢复活力的方式。但有时在分裂的过程中会产生突变,一些突变则是进化的驱动力,而其它一些突变可能对机体有害。先前的研究发现,随着时间的流逝,年龄的增长,可能会产生突变,这可能是有益的,也可能不是有益的。然而,科学家们至今仍未完全理解细胞分裂产生的突变的生物学意义。
先前的研究表明,克隆性造血是一种常见的与年龄相关的现象,其中血液中的造血干细胞或其他祖细胞参与形成与常规血细胞遗传上不同的血细胞群体。此外,某些突变可能是良性的,但已发现其他一些突变会引发癌前病变。这项新工作的研究人员试图了解有关此过程的更多信息。
这项工作涉及分析来自9个公共数据库的有关50,000多名癌症患者的血液肿瘤数据的信息。他们针对每个样本的变异等位基因频率(VAF)进行了编目分类。然后,他们使用数据建立了代表造血干细胞动力学的随机分支模型。除其他外,他们的模型显示中性突变要么很快灭绝,要么生长缓慢,并保持较低的VAF值。而且还表明,有益突变呈指数增长。综上所述,该模型表明,对有益突变的积极选择(而不是遗传漂移)决定了血液的遗传多样性。
3.Nat Commun:揭示有望帮助开发新型血液癌症疗法的新型信号通路
doi:10.1038/s41467-020-14478-8
近日,一项刊登在国际杂志Nature Communications上的研究报告中,来自Hackensack Meridian健康中心的科学家们通过研究发现,逆转骨髓中失控的炎症或有望帮助开发治疗某些血液癌症的新型疗法。文章中,研究者揭示了血管内皮细胞如何调节骨髓微环境中的炎性压力。
文章中,研究者揭示了两种参与骨髓抑制损伤(就像化疗所引发的)的关联通路的功能,在这种状况下,骨髓的活性会被降低,从而导致血细胞产量减少;骨髓抑制会导致促分裂原活化蛋白激酶(MAPK)通路的慢性激活,从而引发局部和系统性炎症,其反过来又受到了NF-kB信号通路的驱动作用;这种慢性炎症会干扰血管的完整性及造血干细胞的功能缺陷。
利用遗传模型来阻断NF-kB依赖性的内皮细胞炎症,研究人员发现了一种名为SCGFa(干细胞生长因子α,Stem Cell Growth Factor Alpha)的新型蛋白,当在骨髓抑制疗法(诸如化疗)后注入SCGFa蛋白或能维持血管功能,促进造血功能恢复及改善造血干细胞的功能,此外科学家们还能通过给予SCGFa来抑制血管和造血炎症,从而促进机体炎症后的恢复过程。
研究者Pradeep Ramalingam表示,我们发现,SCGFa能作为治疗用途使用,其能促进骨髓抑制后机体重要系统功能的恢复;由于老年人无法像年轻人一样经历过多的化疗,其在接受癌症治疗时往往表现较差,从而就会导致骨髓抑制性损伤的发生;如果给患者输注SCGFa,或许就能保护其机体的造血系统并促进其骨髓的快速再生和更新,这就能够给予患者更多的化疗,最终改善患者的预后并降低其疾病复发率。
4.Cell Stem Cell:造血干细胞有助于提高骨髓移植效率
doi:10.1016/j.stem.2020.01.013
根据2月27日发表在《Cell Stem Cell》杂志上的一项研究,西奈山的研究人员发现了一种增强造血干细胞效力的方法,这可能为新的骨髓移植方法打开了大门。

图片来源:Wikipiedia。
骨髓移植可以治愈许多血液疾病和实体瘤,而造血干细胞的稀缺严重限制了骨髓移植。西奈山研究小组的报告称,通过调控溶酶体周围的代谢活性,可以使造血干细胞在骨髓移植中的功效提高90倍以上。
“造血干细胞一旦在培养皿中培养,就会失去干细胞潜能,这限制了它们在实验室培养中易于繁殖的能力,”医学发展与再生生物学教授Saghi Ghaffari说道“为了使这些干细胞保持最佳效能,它们不应该时刻处于分裂状态,而是应处于休眠或静止状态。溶酶体是这些细胞休眠的关键。我们进一步了解到,抑制溶酶体活性可增强干细胞的静止性和效力,并可能具有治疗价值。”
通过在小鼠中进行研究,西奈山的科学家使用了有效而又特异的溶酶体抑制剂,可降低溶酶体的酸度和细胞中氨基酸的释放。最终结果是将具有活化溶酶体的干细胞恢复到静止状态。这项研究进一步发现,抑制糖酵解反应还可以增强造血干细胞的静止性和分裂潜力。
5.Nature:科学家成功实现原始造血干祖细胞的活体动物成像
doi:10.1038/s41586-020-1971-z
近日,一项刊登在国际杂志Nature上题为“Live-animal imaging of native haematopoietic stem and progenitor cells”的研究报告中,来自哈佛大学等机构的科学家们通过研究在活体动物中对原始的造血干祖细胞(native haematopoietic stem and progenitor cells)成功进行了成像研究。
当前,造血干细胞(HSCs,haematopoietic stem cells)的生物学研究主要是在移植条件下进行的,因此,对于科学家们而言,研究造血干细胞的行为就显得极具挑战,据研究者所知,目前研究人员尚未在活体动物的天然生境中实现对造血干细胞的可视化研究。这项研究中,研究人员就描述了一种双重的遗传性策略,其能将报告基因标记限定到最安静的长期造血干细胞(LT-HSCs)的亚群中,并且其能与当前头颅骨髓的活体成像方法相互兼容。
研究者表示,LT-HSCs的亚群既能靠近窦状血管又能靠近血管内皮表面,相比之下,多潜能祖细胞(MPPs,multipotent progenitor cells)与内皮细胞的距离变化更大,且其更有可能与过渡区血管相关联;LT-HSCs并不存在于最深处缺氧的骨髓生境中,而且会在类似于MPPs的缺氧环境中被发现。体内延时成像结果显示,LT-HSCs在稳定状态下的运动能力非常有限,而被激活的LT-HSCs则会表现出一些异质性反应,一些细胞会变得高度活跃,一小部分HSCs则会在空间受限的区域内呈现无性扩张状态;研究者表示,这些区域具有明确的特征,因为HSC的扩张几乎只会在具有骨骼重建活性的骨髓腔亚群中被发现,而相比较之下,具有较低骨吸收活性的腔体并不存在扩张的HSCs。
6.Nat Med:临床试验表明造血干细胞基因疗法有望治疗X连锁慢性肉芽肿病
doi:10.1038/s41591-019-0735-5
X连锁慢性肉芽肿病(X-linked chronic granulomatous disease, X-CGD)是一种罕见的遗传性血液疾病。它可导致反复感染、延长住院治疗时间和缩短寿命。在此之前,X-CGD患者不得不依赖骨髓捐献来获得病情缓解的机会。
在一项新的研究中,来自英国、美国、法国和德国的研究人员报道使用干细胞基因疗法治疗9名X-CGD患者:其中的6名患者目前病情缓解,并且停止了其他治疗。相关研究结果于2020年1月27日在线发表在Nature Medicine期刊上,论文标题为“Lentiviral gene therapy for X-linked chronic granulomatous disease”。

图片来自Nature Medicine, 2020, doi:10.1038/s41591-019-0735-5。
论文共同通讯作者、美国加州大学旧金山分校伊莱和伊迪特-布罗德再生医学与干细胞研究中心(Eli and Edythe Broad Center of Regeneration Medicine and Stem Cell Research)的Donald Kohn博士说,“通过这种基因疗法,你能够使用患者自己的干细胞替代供者细胞用于移植。这意味着这些细胞与患者完全匹配,它应当是一种更加安全的移植方法,没有产生免疫排斥的风险。”
7.Science子刊:供者造血干细胞中的罕见有害突变可能给受者带来健康问题
doi:10.1126/scitranslmed.aax6249
造血干细胞移植,也称为骨髓移植,是治疗急性髓细胞白血病(AML)等血液癌症的常见方法。这种治疗可以治愈血液癌症,但也可能导致危及生命的并发症,包括心脏问题和移植物抗宿主病。在移植物抗宿主病中,来自供者的新免疫细胞会攻击患者的健康组织。
在一项新的研究中,来自美国华盛顿大学医学院等研究机构的研究人员指出在健康供者的造血干细胞中存在的极其罕见的有害基因突变,尽管不会对供者造成健康问题,但是可能会传递给接受造血干细胞移植的癌症患者。在移植前患者接受放疗和化疗以及服用免疫抑制剂使得携带这些罕见突变的造血干细胞有机会快速地增殖,从而给接受造血干细胞移植的患者带来健康问题,比如心脏损伤、移植物抗宿主病和可能的新白血病。相关研究结果发表在2020年1月15日的Science Translational Medicine期刊上,论文标题为“Engraftment of rare, pathogenic donor hematopoietic mutations in unrelated hematopoietic stem cell transplantation”。
这项涉及AML患者及其造血干细胞供者样本的研究表明这些罕见的有害突变存在于非常年轻的供者中,可给受者带来健康问题,即使这些突变非常罕见以致于利用传统基因组测序技术无法在供者中检测到,也会如此。这些研究结果为在更多的健康供者中探究这些罕见突变的更大型研究打开了大门,从而可能导致人们开发出方法来阻止或减轻这类遗传错误给接受造血干细胞移植的患者带来的健康问题。
8.Stem Cell Rep:癌症研究帮助开发有用的造血干细胞
doi:10.1016/j.stemcr.2019.12.009
在超过25年的时间里,大量的研究工作试图使个性化的血液干细胞用于治疗白血病以及许多其他类型疾病。研究人员采取的一种方法是采集患者的成年细胞,然后对其进行“解码”,以产生诱导性多能干细胞(iPSC),该干细胞能够形成人体的任何细胞类型,包括血细胞在内。不幸的是,这些iPSC也有可能发育成癌细胞。因此研究人员将工作重心重新集中在制造造血干细胞(HSC)上,造血干细胞不能制造任何类型的细胞,但可以产生多种类型的血细胞。好消息是,HSC似乎不会像iPSC一样引起癌症。坏消息是研究人员无法创建可以在体内保持生长的HSC。

图片来源:Www.pixabay.com。
现在,科罗拉多大学癌症中心的一项研究介绍了一种诱导HSC产生的新方法。“我的实验室正在研究一种名为MLL的基因,当该基因与另一种基因意外融合时,会导致儿童白血病的发生。” CU癌症中心研究人员兼CU医学院儿科学系教授Patricia Ernst博士说。换句话说,MLL基因的功能失常是有害的,恩斯特则希望找到使这种致癌融合基因的功能失活的方法。但是要了解如何应对功能失常的MLL,Ernst和她的团队需要了解正常情况下MLL的工作原理。
Ernst的研究表明,多能干细胞中常规MLL蛋白的过表达可以推动这些细胞产生更多的血细胞。该发现可能有助于开发有用的HSC,从而可以在化疗和放疗后使白血病患者的血液系统再生。相关结果发表在最近的《Stem Cell Reports》杂志上。
9.Nature:重磅!科学家鉴别出能控制人类血液干细胞自我更新的特殊蛋白!
doi:10.1038/s41586-019-1790-2
近日,一项刊登在国际杂志Nature上的研究报告中,来自加利福尼亚大学的科学家们通过研究发现了一种特殊蛋白和人类学学干细胞自我更新能力之间的关联,研究者表示,激活该蛋白或能促进血液干细胞在实验室条件下自我更新至少12倍。在体外条件下增殖血液干细胞往往能极大地改善血液癌症(比如白血病)和多种遗传性血液疾病的治疗选择。
研究者发现,MLLT3基因的表达与血液干细胞自我更新的潜能密切相关,MLLT3基因所表达的蛋白能为血液干细胞提供必要的指令来使其能够维持自我更新的能力,其能通过与其它调节性蛋白协同作用来保持血液干细胞的重要部分在细胞分类时能正常发挥作用。研究者想知道是否在实验室培养皿中维持血液干细胞中MLLT3蛋白的水平就足以改善其自我更新的能力,利用一种病毒载体,研究人员就能将活性的MLLT3基因插入到血液干细胞中,同时他们观察到,功能性的血液干细胞会在实验室培养皿中的繁殖速率增长了至少12倍。
后期研究人员还将继续深入研究确定哪些特殊蛋白和血液干细胞DNA中的哪些元件会影响MLLT3基因的开关,以及如何在实验室培养皿中利用特殊制剂来控制这一过程,研究者有信心开发出新型策略,在不使用病毒载体的情况下开启/关闭MLLT3基因的表达,以便其能在临床条件下安全使用。
10.Nat Cell Biol:胚胎晚期以及青年阶段会出现造血干细胞的“波动性”产生
doi:10.1038/s41556-019-0410-6
近日,来自Hubrecht Institute等机构的研究人员发现,晚期胎儿和年轻人的骨髓中会出现了以前从未被发现到的“造血波动”现象。这种短暂的造血过程填补胚胎血液生产结束与成年骨髓造血开始两者之间的空白。相关结果于11月4日发表在《Nature Cell Biology》杂志上。
胚胎发育过程中的第一批HSC是通过内皮细胞向造血系统的转化而产生的,这一过程被称为“endothelial to hematopoietic transition(EHT)”。在脊椎动物的胚胎发育过程中,EHT在主动脉中短暂地出现。HSC数量会扩增,然后再迁移到骨髓组织中直到成年。迄今为止,我们尚不清楚EHT是否在胚胎期之后仍会发生,如果有的话,具体的发生地点又在何处?
为了查明EHT的发生机制,研究人员结合实验胚胎学,遗传学,转录组学和功能学等方法,通过鸡和小鼠模型进行研究。通过荧光基因标记和实时成像分析追踪形成骨髓的内皮细胞,他们发现骨髓的整个血管网络都来自一种叫做“体节”的组织。体节构成机体的“片段”,随着胚胎的发展,这些部分将逐渐形成生物体的重要组织,包括骨骼,肌肉和皮肤。出乎意料的是,研究人员发现,某些迄今仅在胚胎中观察到的内皮祖细胞,通过同样的EHT过程在胎儿晚期和成年骨髓中产生了HSCs和多能祖细胞。这些细胞与传统意义上的HSC的细胞非常相似,具有明显的Notch信号,以及表达EHT特异性的内皮组织相关基因和转录因子。因此,结果表明,HSC同样能够在胚胎期后产生,这与胚胎中的发生机制相同。
11.NEJM:世界首例!中国科学家找到治疗艾滋病和白血病新方法!
doi:10.1056/NEJMoa1817426
近日,一项刊登在国际杂志The New England Journal of Medicine上的研究报告中,来自北京大学-清华大学生命科学联合中心邓宏魁研究组、解放军总医院第五医学中心陈虎研究组及首都医科大学附属北京佑安医院吴昊研究组的研究人员通过联合研究发表了题为“CRISPR-Edited Stem Cells in a Patient with HIV and Acute Lymphocytic Leukemia”(利用CRISPR基因编辑的成体造血干细胞在患有艾滋病合并急性淋巴细胞白血病患者中的长期重建)的研究论文,这项研究成果标志着世界上首例通过基因编辑干细胞治疗艾滋病和白血病患者的案例由我国科学家成功完成了!

CCR5修饰的HSPCs的移植,图片来源:Lei Xu et al. N Engl J Med 2019 DOI:10.1056/NEJMoa1817426。
我们都知道,如今CRISPR-Cas9基因编辑工具对哺乳动物细胞的基因组进行编辑已经被广泛使用了,该技术展现出了潜在的临床使用前途,而且目前研究人员已经开始利用该技术来探寻基于CRISPR的疗法治疗人类疾病的安全性和可行性。CCR5是HIV-1感染人体的一个保护性靶点,CCR5缺失的血细胞常常对HIV-1的感染有很大的抵抗力;有研究表明,当将携带天然CCR5突变的造血干细胞和祖细胞(HSPCs,hematopoietic stem and progenitor cells,造血干祖细胞)进行同种异体移植后(allogeneic transplantation)就能长期根除HIV-1,因为CCR5是HIV进入机体的关键共受体,这些事例或许就增加了一种可能性,即移植携带人工破坏CCR5的细胞或能作为一种新方法来制造对HIV-1感染耐受的细胞。
中国科学家的这项最新研究描述了同种异体干细胞移植后CCR5 CRISPR基因编辑的CD34+细胞的长期移植状况,其对循环骨髓细胞基因组的基因干扰比率不到8%,而且并不存在基因编辑的脱靶效应。这项长达多年的工作目前已经初步证实了基因编辑造血干细胞在临床应用中的可行性与安全性,未来将会促进和推动该技术的临床应用。未来研究人员将会继续深入研究通过各种方法来优化基因编辑造血干细胞移植方案,从而降低脱靶率,实现100%的CCR5的敲除效率。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


