CAR-T细胞疗法研究进展(第11期)
来源:本站原创 2019-12-31 23:59
近年来,CAR-T免疫疗法除了被用来治疗急性白血病和非霍奇金淋巴瘤之外,经改进后,也被用来治疗实体瘤、自身免疫疾病、HIV感染和心脏病等疾病,具有更广阔的应用空间。基于此,针对CAR-T细胞疗法取得的最新进展,小编进行一番盘点,以飨读者。
2019年12月31日讯/生物谷BIOON/---CAR-T(Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。该疗法是一种出现了很多年但近几年才被改良使用到临床中的新型细胞疗法。在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被认为是最有前景的肿瘤治疗方式之一。正如所有的技术一样,CAR-T技术也经历一个漫长的演化过程,正是在这一系列的演化过程中,CAR-T技术逐渐走向成熟。
这种新的治疗策略的关键之处在于识别靶细胞的被称作嵌合抗原受体(chimeric antigen receptor, CAR)的人工受体,而且在经过基因修饰后,病人T细胞能够表达这种CAR。在人体临床试验中,科学家们通过一种类似透析的过程提取出病人体内的一些T细胞,然后在实验室对它们进行基因修饰,将编码这种CAR的基因导入,这样这些T细胞就能够表达这种新的受体。这些经过基因修饰的T细胞在实验室进行增殖,随后将它们灌注回病人体内。这些T细胞利用它们表达的CAR受体结合到靶细胞表面上的分子,而这种结合触发一种内部信号产生,接着这种内部信号如此强效地激活这些T细胞以至于它们快速地摧毁靶细胞。
近年来,CAR-T免疫疗法除了被用来治疗急性白血病和非霍奇金淋巴瘤之外,经改进后,也被用来治疗实体瘤、自身免疫疾病、HIV感染和心脏病等疾病,具有更广阔的应用空间。基于此,针对CAR-T细胞疗法取得的最新进展,小编进行一番盘点,以飨读者。
1.Cell:人胶质母细胞瘤类器官可重现肿瘤特征,并可用于评价药物和CAR-T细胞的疗效
doi:10.1016/j.cell.2019.11.036
胶质母细胞瘤是最为侵袭性的最为常见的脑癌形式。由患者自身的胶质母细胞瘤培育而成的实验室大脑类器官可能为如何最好地治疗它提供了答案。在一项新的研究中,来自美国宾夕法尼亚 大学的研究人员发现胶质母细胞瘤类器官可能可以作为有效的模型来快速地测试个性化治疗策略。相关研究结果于2019年12月26日在线发表在Cell期刊上,论文标题为“Genomic Relationships, Novel Loci, and Pleiotropic Mechanisms across Eight Psychiatric Disorders”。
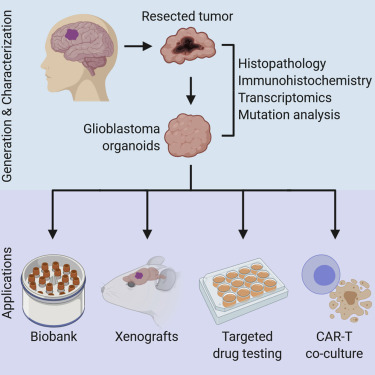
在这项新研究中,这些研究人员从52名患者中取出了新鲜的肿瘤样本,以便在实验室中“培养出”相应的肿瘤类器官。在两周内,产生胶质母细胞瘤类器官的总成功率为91.4%,其中66.7% 的肿瘤显示出IDH1突变,75%的复发性肿瘤显示出IDH1突变。这些胶质母细胞瘤类器官也可以在生物库中存储,以便用于以后的分析。
这些研究人员还在12名患者中进行了遗传、组织学和分子分析,以便确定这些新的胶质母细胞瘤类器官在很大程度上保留了患者原发性肿瘤的特征。他们将8例胶质母细胞瘤类器官样本成功地 移植到成年小鼠的大脑中,它们的大脑显示出癌细胞的快速侵袭性浸润,并且在三个月后维持关键的突变基因表达。重要的是,在小鼠模型中观察到了胶质母细胞瘤的一种主要特征---肿瘤细 胞浸润到周围的大脑组织中。
为了模拟手术后的治疗方法,这些研究人员对胶质母细胞瘤类器官进行了标准治疗和靶向治疗,包括来自临床试验的药物和嵌合抗原受体(CAR)T细胞(CAR-T)免疫疗法。对于每种疗法,他 们发现这些类器官对治疗作出的反应是不同的,而且治疗的有效性与患者肿瘤中的基因突变相关。这种模型为基于患者肿瘤对不同药物反应进行个体化治疗的未来临床试验提供了可能性。
2.临床研究表明CAR-T细胞疗法可有效治疗复发性套细胞淋巴瘤
新闻来源:CAR T-cell therapy effective for relapsed mantle cell lymphoma patients
由美国德克萨斯大学MD安德森癌症中心领导的一项为期一年的随访研究显示大多数对先前疗法有抵抗力的套细胞淋巴瘤(mantle cell lymphoma)患者可能会受益于靶向CD19的嵌合抗原受体 (CAR)T细胞(CAR-T)疗法。相关研究结果于2019年12月9日在佛罗里达州奥兰多市举行的第61届美国血液学学会年会暨展览会上发表。
这项多中心的II期临床研究(称为ZUMA-2)报道,有93%的患者对这种CAR-T细胞疗法有反应,其中67%的患者获得了完全反应。在接受治疗的前28名患者中,有43%的人在两年后仍处于缓解 状态。
这项研究报道了3级副作用,最常见的是贫血和血小板减少。大多数患者都经历了细胞因子释放综合征,这是CAR-T细胞疗法的常见副作用,但是这种综合征在所有患者中均得到有效控制。
3.Nature子刊:厉害!薄薄的金属膜可将CAR-T细胞高效递送到实体瘤中
doi:10.1038/s41551-019-0486-0
在一项新的研究中,来自美国弗雷德哈钦森癌症研究中心的研究人员首次发现一块小而薄的装载着抗癌免疫细胞的金属网可在卵巢癌临床前模型中缩小肿瘤。相关研究结果近期发表在Nature Biomedical Engineering期刊上,论文标题为“Nitinol thin films functionalized with CAR-T cells for the treatment of solid tumours”。

论文通讯作者、弗雷德哈钦森癌症研究中心研究员Matthias Stephan博士说,“对抗癌症的细胞疗法在血癌中取得了巨大的成功,但在实体瘤方面效果不佳。我们的发现表明装载有经过基因 改造后对抗卵巢癌的T细胞的薄金属网可清除70%的经过治疗的小鼠中的肿瘤,这使得我们在朝着让细胞疗法有效对抗实体瘤的目标上迈出了重要的一步。”
4.Nature:突破!科学家成功对T细胞重编程来改善癌症免疫疗法的功效!
doi:10.1038/s41586-019-1821-z
日前,一项刊登在国际杂志Nature上的研究报告中,来自圣犹大儿童研究医院等机构的科学家们通过研究开发了一种有效增强癌症免疫疗法的新型治疗策略,其或能有效减缓肿瘤的生长并延 长患癌小鼠的寿命。本文研究发现或能为开发更有效的过继细胞疗法(adoptive cell therapy)提供一种有希望的策略,比如CAR T细胞疗法;免疫疗法旨在利用患者机体自身的肿瘤特异性T 细胞来进行癌症治疗,当这些T细胞被重新输入到患者机体之前,研究人员会对其进行收集、功能扩展等操作,当重新输入到患者体内后,有些患者会对疗法产生显著性的反应,而过继细胞疗 法或许无法有效抵御实体瘤。
文章中,研究人员利用CRISPR-Cas9技术在肿瘤特异性T细胞中识别出了一种特殊的酶类分子,该分子类似于“制动器”,其能关闭机体的抗肿瘤免疫反应,当这种名为REGNASE-1的酶类分子被 剔除后,T细胞就会变得长寿,且疗效及在肿瘤中的积累量就会增加,当利用缺失REGNASE-1的T细胞治疗白血病和黑色素瘤小鼠时,小鼠的寿命会延长,而且相比常规T细胞(野生型)治疗的 小鼠而言,这些小鼠机体中的肿瘤尺寸也缩小了。
研究者Jun Wei说道,此前研究者发现REGNASE-1能够限制T细胞的激活,而本文研究中我们发现,REGNASE-1同样也能抑制两种重要的T细胞信号通路;研究人员利用CRISPR-Cas9进行筛查后发 现,转录因子BATF和TCF-1或许能作为REGNASE-1的靶点;研究者指出,BATF能够驱动T细胞的代谢从而增强T细胞的积累及杀灭肿瘤细胞的能力,而TCF-1则能够促进T细胞长寿,传统观点认为 ,上述过程是相互作用的,增加T细胞的抗肿瘤活性意味着T细胞变得更加长寿了,而本文研究结果发现实际上或许并非这样。
研究者表示,联合疗法或许是癌症免疫疗法获得临床成功的关键,为此,研究人员还想对这一研究发现的临床潜力提供更多的见解,通过进行第二次CRISPR-Cas9筛选后,研究人员鉴别出了两 种更具关联的分子,当这些分子(信号因子PTPN2和SOCS1)与REGNASE-1一起被剔除后,小鼠机体中T细胞在癌症免疫疗法中的表现会被明显改善, PTPN2和SOCS1分子或许并不依赖于 REGNASE-1而发挥作用。后期研究人员还会进行更为深入的研究来阐明如何通过靶向作用REGNASE-1来开发新型的抗癌疗法。
5.Nature:科学家开发出新一代对“疲惫”状态耐受的CAR-T细胞来成功抵御实体瘤
doi:10.1038/s41586-019-1805-z
近日,一项刊登在国际杂志Nature上的研究报告中,来自斯坦福大学医学中心的科学家们通过研究开发了一种新方法,其或能重编程CAR-T细胞(抵御癌症的免疫细胞)来延长其自身的活性并 增加抵御实验室培养和小鼠机体中人类癌细胞的潜能。
2017年,CAR-T细胞成为全球关注的明星细胞,此后FDA批准其用于治疗复发或无反应性急性淋巴细胞白血病,同年晚些时候,CAR-T细胞疗法的另一个版本也被批准用来治疗某些类型的淋巴瘤 。尽管血液癌症对CAR-T细胞疗法反应较好,但仍有不到一半的患者需要长期控制他们的疾病,通常是因为CAR-T细胞“疲惫”了,其失去了不断增殖并抵御癌细胞的能力,克服这种“疲惫” 状态或是多年来癌症研究人员进行大量研究的目的。
这项研究中,研究人员通过研究分析了当T细胞“疲惫”时会发生什么,以及是否他们有可能有效抑制这种细胞的“疲惫”;研究人员利用了一种名为ATAC-Seq的新技术就能够确定调节性回路 过表达或低表达基因的基因组区域。Mackall博士说道,当我们使用这种技术来对比健康和“疲惫”T细胞的基因组时,我们识别出了基因表达模式的某些明显的差异,尤其是我们发现,“疲 惫”的T细胞会表现出一大类基因表达活性的失衡,这些基因能够调节细胞中特殊蛋白的水平,从而增加抑制自身活性的蛋白的表达。
当研究人员通过过表达c-Jun基因(能增加与T细胞活性相关的蛋白的表达)来修饰CAR-T细胞使其恢复平衡后,他们发现,细胞能够维持活性状态并在实验室条件下增殖,即便是在细胞处于“ 疲惫”的状态下也依然会如此;相比常规CAR-T细胞治疗而言,利用修饰的CAR-T细胞进行治疗会使得注射人类白血病细胞的小鼠活得更久;此外,表达c-Jun的CAR-T细胞也会降低肿瘤负担, 并延长携带人类骨肉瘤的实验室小鼠的寿命。
6.JACC:CAR-T疗法与不良心血管事件的相关性研究
doi:10.1016/j.jacc.2019.10.038
嵌合抗原受体重定向T细胞(CAR-T)用于靶向治疗肿瘤细胞,本研究的目的旨在评估CAR-T可能的心脏毒性。
本研究纳入分析了137名接受了CAR-T治疗的患者,心脏毒性定义为左室射血分数的降低或血清肌钙蛋白水平的增高。患者的平均年龄为62岁(男性占67%,88%患有淋巴瘤,8%患有骨髓瘤)。近50%的患者接受的是商业CAR-T治疗,剩下的接受的是非商业CAR-T治疗。细胞因子释放综合征(CRS)出现在接受CAR-T治疗后平均5天内,有56名CRS患者接受了Tocilizumab治疗,有54%患者出现了血清肌钙蛋白水平的增高,28%患者的左室射血分数出现降低,这些情况均出现在CRS等级≥2的患者中。
研究结果显示,在接受CAR-T治疗的成年患者中,会出现心肌损伤和不良心血管事件,细胞因子释放综合征、血清肌钙蛋白和不良心血管事件呈相关性。
7.Blood:死亡受体信号调节CAR-T细胞毒性
doi:10.1182/blood.2019002121
嵌合抗原受体(CAR)T细胞疗法已被证实对于复发性/难治性B细胞恶性肿瘤具有一定疗效,但仍有一定的耐药或复发病例出现。深入了解影响CAR T细胞毒性的机制和通过小分子药物调控的潜在机制有助于改善目前的免疫疗法。
现研究人员使用了500多种小分子药物和基因组级的CRISPR-Cas9功能缺失筛选,系统地研究了CAR T细胞毒性的药物机制。结果显示多种酪氨酸激酶抑制剂可通过破坏T细胞信号的转录活性抑制CAR T细胞毒性。相反,促凋亡小分子药物SMAC类似物可增加急性B淋巴细胞白血病(B-ALL)和弥漫性大B细胞淋巴瘤(DLBCL)细胞对抗CD19 CAR T细胞的敏感性。
CRISPR筛选通过FADD和TNFRSF10B (TRAIL-R2)作为CAR T细胞毒性的关键介质筛选出死亡受体信号,并阐明了SMAC类似物致敏的RIPK1依赖机制。死亡受体的表达在B细胞恶性肿瘤的基因亚型中存在差异,提示CAR T细胞的细胞毒性机制与癌症遗传有关。
综上所述,本研究结果提示死亡受体信号是癌细胞对CAR-T细胞毒性敏感性的重要调节因子,具有通过药物靶向增强癌症免疫治疗效果的潜力。本研究揭示了癌症药物的免疫调节特性和影响CAR T细胞毒性的遗传机制。
8.英国授权开展全球首个针对肾脏移植免疫排斥反应的CAR-Treg细胞疗法临床研究
新闻来源:UK authorisation granted for first in-human CAR-Treg cell therapy study
英国药品保健产品监管局(MHRA)已授权Sangamo Therapeutics开展首个嵌合抗原受体调节性T细胞(CAR-Treg)疗法TX200的临床试验STEADFAST。TX200正在研究用于预防HLA-A2错配肾脏移植治疗终末期肾脏疾病(ESRD)后免疫介导的排斥反应。
研究与开发负责人Adrian Woolfson说:"我们相信TX200实验计划对于扩大我们对CAR-Treg细胞的安全性和作用机制及其在临床应用的了解将是无价的。这种针对HLA-A2错配肾移植的创新性和个性化细胞疗法,旨在帮助局部调节人体的免疫系统,以促进接受免疫错配的供体器官。除了移植,我们计划探索CAR-Tregs在一系列自身免疫和炎性疾病中的潜力。"
TX200是一种针对HLA-A2的自体(从患者收集的细胞)CAR-Treg细胞疗法。收集患者的调节性T细胞(Tregs),并将嵌合抗原受体(CAR)设计与人白细胞抗原HLA-A2蛋白结合。
HLA分子中的供体/受体错配是器官移植不相容的主要原因,可能最终导致免疫介导的移植器官排斥。受体的免疫系统可以识别这种HLA-A2错配,并可能攻击携带HLA-A2蛋白的新肾脏,从而导致移植排斥。TX200 HLA-A2 CAR-Treg细胞被设计利用Treg抑制移植肾的免疫反应。(生物谷 Bioon.com)
这种新的治疗策略的关键之处在于识别靶细胞的被称作嵌合抗原受体(chimeric antigen receptor, CAR)的人工受体,而且在经过基因修饰后,病人T细胞能够表达这种CAR。在人体临床试验中,科学家们通过一种类似透析的过程提取出病人体内的一些T细胞,然后在实验室对它们进行基因修饰,将编码这种CAR的基因导入,这样这些T细胞就能够表达这种新的受体。这些经过基因修饰的T细胞在实验室进行增殖,随后将它们灌注回病人体内。这些T细胞利用它们表达的CAR受体结合到靶细胞表面上的分子,而这种结合触发一种内部信号产生,接着这种内部信号如此强效地激活这些T细胞以至于它们快速地摧毁靶细胞。
近年来,CAR-T免疫疗法除了被用来治疗急性白血病和非霍奇金淋巴瘤之外,经改进后,也被用来治疗实体瘤、自身免疫疾病、HIV感染和心脏病等疾病,具有更广阔的应用空间。基于此,针对CAR-T细胞疗法取得的最新进展,小编进行一番盘点,以飨读者。
1.Cell:人胶质母细胞瘤类器官可重现肿瘤特征,并可用于评价药物和CAR-T细胞的疗效
doi:10.1016/j.cell.2019.11.036
胶质母细胞瘤是最为侵袭性的最为常见的脑癌形式。由患者自身的胶质母细胞瘤培育而成的实验室大脑类器官可能为如何最好地治疗它提供了答案。在一项新的研究中,来自美国宾夕法尼亚 大学的研究人员发现胶质母细胞瘤类器官可能可以作为有效的模型来快速地测试个性化治疗策略。相关研究结果于2019年12月26日在线发表在Cell期刊上,论文标题为“Genomic Relationships, Novel Loci, and Pleiotropic Mechanisms across Eight Psychiatric Disorders”。

图片来自Cell, 2019, doi:10.1016/j.cell.2019.11.036。
在这项新研究中,这些研究人员从52名患者中取出了新鲜的肿瘤样本,以便在实验室中“培养出”相应的肿瘤类器官。在两周内,产生胶质母细胞瘤类器官的总成功率为91.4%,其中66.7% 的肿瘤显示出IDH1突变,75%的复发性肿瘤显示出IDH1突变。这些胶质母细胞瘤类器官也可以在生物库中存储,以便用于以后的分析。
这些研究人员还在12名患者中进行了遗传、组织学和分子分析,以便确定这些新的胶质母细胞瘤类器官在很大程度上保留了患者原发性肿瘤的特征。他们将8例胶质母细胞瘤类器官样本成功地 移植到成年小鼠的大脑中,它们的大脑显示出癌细胞的快速侵袭性浸润,并且在三个月后维持关键的突变基因表达。重要的是,在小鼠模型中观察到了胶质母细胞瘤的一种主要特征---肿瘤细 胞浸润到周围的大脑组织中。
为了模拟手术后的治疗方法,这些研究人员对胶质母细胞瘤类器官进行了标准治疗和靶向治疗,包括来自临床试验的药物和嵌合抗原受体(CAR)T细胞(CAR-T)免疫疗法。对于每种疗法,他 们发现这些类器官对治疗作出的反应是不同的,而且治疗的有效性与患者肿瘤中的基因突变相关。这种模型为基于患者肿瘤对不同药物反应进行个体化治疗的未来临床试验提供了可能性。
2.临床研究表明CAR-T细胞疗法可有效治疗复发性套细胞淋巴瘤
新闻来源:CAR T-cell therapy effective for relapsed mantle cell lymphoma patients
由美国德克萨斯大学MD安德森癌症中心领导的一项为期一年的随访研究显示大多数对先前疗法有抵抗力的套细胞淋巴瘤(mantle cell lymphoma)患者可能会受益于靶向CD19的嵌合抗原受体 (CAR)T细胞(CAR-T)疗法。相关研究结果于2019年12月9日在佛罗里达州奥兰多市举行的第61届美国血液学学会年会暨展览会上发表。
这项多中心的II期临床研究(称为ZUMA-2)报道,有93%的患者对这种CAR-T细胞疗法有反应,其中67%的患者获得了完全反应。在接受治疗的前28名患者中,有43%的人在两年后仍处于缓解 状态。
这项研究报道了3级副作用,最常见的是贫血和血小板减少。大多数患者都经历了细胞因子释放综合征,这是CAR-T细胞疗法的常见副作用,但是这种综合征在所有患者中均得到有效控制。
3.Nature子刊:厉害!薄薄的金属膜可将CAR-T细胞高效递送到实体瘤中
doi:10.1038/s41551-019-0486-0
在一项新的研究中,来自美国弗雷德哈钦森癌症研究中心的研究人员首次发现一块小而薄的装载着抗癌免疫细胞的金属网可在卵巢癌临床前模型中缩小肿瘤。相关研究结果近期发表在Nature Biomedical Engineering期刊上,论文标题为“Nitinol thin films functionalized with CAR-T cells for the treatment of solid tumours”。

图片来自Fred Hutchinson Cancer Research Center。
论文通讯作者、弗雷德哈钦森癌症研究中心研究员Matthias Stephan博士说,“对抗癌症的细胞疗法在血癌中取得了巨大的成功,但在实体瘤方面效果不佳。我们的发现表明装载有经过基因 改造后对抗卵巢癌的T细胞的薄金属网可清除70%的经过治疗的小鼠中的肿瘤,这使得我们在朝着让细胞疗法有效对抗实体瘤的目标上迈出了重要的一步。”
4.Nature:突破!科学家成功对T细胞重编程来改善癌症免疫疗法的功效!
doi:10.1038/s41586-019-1821-z
日前,一项刊登在国际杂志Nature上的研究报告中,来自圣犹大儿童研究医院等机构的科学家们通过研究开发了一种有效增强癌症免疫疗法的新型治疗策略,其或能有效减缓肿瘤的生长并延 长患癌小鼠的寿命。本文研究发现或能为开发更有效的过继细胞疗法(adoptive cell therapy)提供一种有希望的策略,比如CAR T细胞疗法;免疫疗法旨在利用患者机体自身的肿瘤特异性T 细胞来进行癌症治疗,当这些T细胞被重新输入到患者机体之前,研究人员会对其进行收集、功能扩展等操作,当重新输入到患者体内后,有些患者会对疗法产生显著性的反应,而过继细胞疗 法或许无法有效抵御实体瘤。
文章中,研究人员利用CRISPR-Cas9技术在肿瘤特异性T细胞中识别出了一种特殊的酶类分子,该分子类似于“制动器”,其能关闭机体的抗肿瘤免疫反应,当这种名为REGNASE-1的酶类分子被 剔除后,T细胞就会变得长寿,且疗效及在肿瘤中的积累量就会增加,当利用缺失REGNASE-1的T细胞治疗白血病和黑色素瘤小鼠时,小鼠的寿命会延长,而且相比常规T细胞(野生型)治疗的 小鼠而言,这些小鼠机体中的肿瘤尺寸也缩小了。
研究者Jun Wei说道,此前研究者发现REGNASE-1能够限制T细胞的激活,而本文研究中我们发现,REGNASE-1同样也能抑制两种重要的T细胞信号通路;研究人员利用CRISPR-Cas9进行筛查后发 现,转录因子BATF和TCF-1或许能作为REGNASE-1的靶点;研究者指出,BATF能够驱动T细胞的代谢从而增强T细胞的积累及杀灭肿瘤细胞的能力,而TCF-1则能够促进T细胞长寿,传统观点认为 ,上述过程是相互作用的,增加T细胞的抗肿瘤活性意味着T细胞变得更加长寿了,而本文研究结果发现实际上或许并非这样。
研究者表示,联合疗法或许是癌症免疫疗法获得临床成功的关键,为此,研究人员还想对这一研究发现的临床潜力提供更多的见解,通过进行第二次CRISPR-Cas9筛选后,研究人员鉴别出了两 种更具关联的分子,当这些分子(信号因子PTPN2和SOCS1)与REGNASE-1一起被剔除后,小鼠机体中T细胞在癌症免疫疗法中的表现会被明显改善, PTPN2和SOCS1分子或许并不依赖于 REGNASE-1而发挥作用。后期研究人员还会进行更为深入的研究来阐明如何通过靶向作用REGNASE-1来开发新型的抗癌疗法。
5.Nature:科学家开发出新一代对“疲惫”状态耐受的CAR-T细胞来成功抵御实体瘤
doi:10.1038/s41586-019-1805-z
近日,一项刊登在国际杂志Nature上的研究报告中,来自斯坦福大学医学中心的科学家们通过研究开发了一种新方法,其或能重编程CAR-T细胞(抵御癌症的免疫细胞)来延长其自身的活性并 增加抵御实验室培养和小鼠机体中人类癌细胞的潜能。

图片来源:CC0 Public Domain。
2017年,CAR-T细胞成为全球关注的明星细胞,此后FDA批准其用于治疗复发或无反应性急性淋巴细胞白血病,同年晚些时候,CAR-T细胞疗法的另一个版本也被批准用来治疗某些类型的淋巴瘤 。尽管血液癌症对CAR-T细胞疗法反应较好,但仍有不到一半的患者需要长期控制他们的疾病,通常是因为CAR-T细胞“疲惫”了,其失去了不断增殖并抵御癌细胞的能力,克服这种“疲惫” 状态或是多年来癌症研究人员进行大量研究的目的。
这项研究中,研究人员通过研究分析了当T细胞“疲惫”时会发生什么,以及是否他们有可能有效抑制这种细胞的“疲惫”;研究人员利用了一种名为ATAC-Seq的新技术就能够确定调节性回路 过表达或低表达基因的基因组区域。Mackall博士说道,当我们使用这种技术来对比健康和“疲惫”T细胞的基因组时,我们识别出了基因表达模式的某些明显的差异,尤其是我们发现,“疲 惫”的T细胞会表现出一大类基因表达活性的失衡,这些基因能够调节细胞中特殊蛋白的水平,从而增加抑制自身活性的蛋白的表达。
当研究人员通过过表达c-Jun基因(能增加与T细胞活性相关的蛋白的表达)来修饰CAR-T细胞使其恢复平衡后,他们发现,细胞能够维持活性状态并在实验室条件下增殖,即便是在细胞处于“ 疲惫”的状态下也依然会如此;相比常规CAR-T细胞治疗而言,利用修饰的CAR-T细胞进行治疗会使得注射人类白血病细胞的小鼠活得更久;此外,表达c-Jun的CAR-T细胞也会降低肿瘤负担, 并延长携带人类骨肉瘤的实验室小鼠的寿命。
6.JACC:CAR-T疗法与不良心血管事件的相关性研究
doi:10.1016/j.jacc.2019.10.038
嵌合抗原受体重定向T细胞(CAR-T)用于靶向治疗肿瘤细胞,本研究的目的旨在评估CAR-T可能的心脏毒性。
本研究纳入分析了137名接受了CAR-T治疗的患者,心脏毒性定义为左室射血分数的降低或血清肌钙蛋白水平的增高。患者的平均年龄为62岁(男性占67%,88%患有淋巴瘤,8%患有骨髓瘤)。近50%的患者接受的是商业CAR-T治疗,剩下的接受的是非商业CAR-T治疗。细胞因子释放综合征(CRS)出现在接受CAR-T治疗后平均5天内,有56名CRS患者接受了Tocilizumab治疗,有54%患者出现了血清肌钙蛋白水平的增高,28%患者的左室射血分数出现降低,这些情况均出现在CRS等级≥2的患者中。
研究结果显示,在接受CAR-T治疗的成年患者中,会出现心肌损伤和不良心血管事件,细胞因子释放综合征、血清肌钙蛋白和不良心血管事件呈相关性。
7.Blood:死亡受体信号调节CAR-T细胞毒性
doi:10.1182/blood.2019002121
嵌合抗原受体(CAR)T细胞疗法已被证实对于复发性/难治性B细胞恶性肿瘤具有一定疗效,但仍有一定的耐药或复发病例出现。深入了解影响CAR T细胞毒性的机制和通过小分子药物调控的潜在机制有助于改善目前的免疫疗法。
现研究人员使用了500多种小分子药物和基因组级的CRISPR-Cas9功能缺失筛选,系统地研究了CAR T细胞毒性的药物机制。结果显示多种酪氨酸激酶抑制剂可通过破坏T细胞信号的转录活性抑制CAR T细胞毒性。相反,促凋亡小分子药物SMAC类似物可增加急性B淋巴细胞白血病(B-ALL)和弥漫性大B细胞淋巴瘤(DLBCL)细胞对抗CD19 CAR T细胞的敏感性。
CRISPR筛选通过FADD和TNFRSF10B (TRAIL-R2)作为CAR T细胞毒性的关键介质筛选出死亡受体信号,并阐明了SMAC类似物致敏的RIPK1依赖机制。死亡受体的表达在B细胞恶性肿瘤的基因亚型中存在差异,提示CAR T细胞的细胞毒性机制与癌症遗传有关。
综上所述,本研究结果提示死亡受体信号是癌细胞对CAR-T细胞毒性敏感性的重要调节因子,具有通过药物靶向增强癌症免疫治疗效果的潜力。本研究揭示了癌症药物的免疫调节特性和影响CAR T细胞毒性的遗传机制。
8.英国授权开展全球首个针对肾脏移植免疫排斥反应的CAR-Treg细胞疗法临床研究
新闻来源:UK authorisation granted for first in-human CAR-Treg cell therapy study
英国药品保健产品监管局(MHRA)已授权Sangamo Therapeutics开展首个嵌合抗原受体调节性T细胞(CAR-Treg)疗法TX200的临床试验STEADFAST。TX200正在研究用于预防HLA-A2错配肾脏移植治疗终末期肾脏疾病(ESRD)后免疫介导的排斥反应。
研究与开发负责人Adrian Woolfson说:"我们相信TX200实验计划对于扩大我们对CAR-Treg细胞的安全性和作用机制及其在临床应用的了解将是无价的。这种针对HLA-A2错配肾移植的创新性和个性化细胞疗法,旨在帮助局部调节人体的免疫系统,以促进接受免疫错配的供体器官。除了移植,我们计划探索CAR-Tregs在一系列自身免疫和炎性疾病中的潜力。"
TX200是一种针对HLA-A2的自体(从患者收集的细胞)CAR-Treg细胞疗法。收集患者的调节性T细胞(Tregs),并将嵌合抗原受体(CAR)设计与人白细胞抗原HLA-A2蛋白结合。
HLA分子中的供体/受体错配是器官移植不相容的主要原因,可能最终导致免疫介导的移植器官排斥。受体的免疫系统可以识别这种HLA-A2错配,并可能攻击携带HLA-A2蛋白的新肾脏,从而导致移植排斥。TX200 HLA-A2 CAR-Treg细胞被设计利用Treg抑制移植肾的免疫反应。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


