罕见肺病新药!Savara公司吸入性GM-CSF药物Molgradex获美国FDA突破性药物资格!
来源:本站原创 2019-12-31 09:36
2019年12月31日讯 /生物谷BIOON/ --Savara Inc.是一家临床阶段的美国生物制药公司,致力于开发和商业化用于治疗严重或威胁生命的罕见呼吸疾病的创新疗法。近日,该公司宣布,美国食品和药物管理局(FDA)已授予Molgradex突破性药物资格(BTD),这是一种重组人粒细胞-巨噬细胞集落刺激因子(GM-CSF)吸入制剂,用于治疗自身免疫性肺

2019年12月31日讯 /生物谷BIOON/ --Savara Inc.是一家临床阶段的美国生物制药公司,致力于开发和商业化用于治疗严重或威胁生命的罕见呼吸疾病的创新疗法。
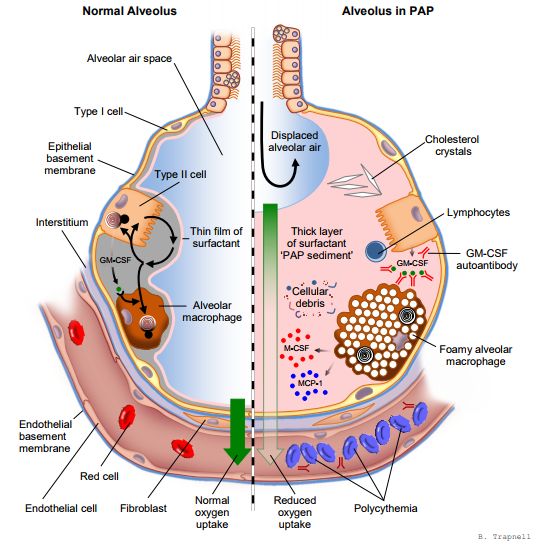
近日,该公司宣布,美国食品和药物管理局(FDA)已授予Molgradex突破性药物资格(BTD),这是一种重组人粒细胞-巨噬细胞集落刺激因子(GM-CSF)吸入制剂,用于治疗自身免疫性肺泡蛋白沉积症(aPAP)。
BTD是FDA在2012年创建的一个新药评审通道,旨在加快开发及审查用于治疗严重或威及生命的疾病并且有初步临床证据表明该药与现有治疗药物相比能够实质性改善病情的新药。获得BTD的药物,在研发时能得到包括FDA高层官员在内的更加密切的指导,保障在最短时间内为患者提供新的治疗选择。
FDA授予Molgradex BTD,基于关键性III期临床研究IMPALA的数据。该研究评估了Molgradex治疗aPAP的疗效和安全性,数据已于最近在西班牙马德里举行的2019年欧洲呼吸学会(ERS)国际大会的口头会议上公布(点击查看详情)。
Savara公司首席执行官Rob Neville表示:“我们很高兴FDA授予Molgradex治疗aPAP的突破性药物资格认定,aPAP是一种致衰性的、罕见的肺部疾病,没有批准的药物治疗方案。我们相信,此次资格认定反映了Molgradex作为一种在研产品的重要性,基于IMPALA研究的数据,该药已经被证明可以改善患者的预后。BTD旨在加强与FDA的合作和更频繁的对话,是我们确定该产品最佳开发道路的一个重要里程碑
。”
Molgradex是Savara公司的一款重要候选产品,这是一种吸入型GM-CSF,治疗自身免疫性肺泡蛋白沉积症(aPAP)处于III期临床;此外,评估Molgradex用于慢性NTM肺部感染的非囊性纤维化(CF)和CF患者治疗NTM肺部感染处于IIa期临床。Savara公司还在开发AeroVanc,这是一种吸入性万古霉素,处于III期阶段,用于治疗CF患者治疗耐甲氧西林金黄色葡萄球菌(MRSA)肺部感染。(生物谷Bioon.com)
原文出处:Savara Pharma
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->



