罕见心脏病迎来新疗法!辉瑞Vyndaqel(tafamidis,61mg胶囊)在欧盟获得推荐批准!
来源:本站原创 2019-12-16 14:44
2019年12月16日讯 /生物谷BIOON/ --制药巨头辉瑞(Pfizer)近日宣布,欧洲药品管理局(EMA)人用医药产品委员会(CHMP)已发布积极审查意见,推荐批准Vyndaqel(tafamidis),该药是一种每日一次的61mg口服胶囊,用于治疗野生型或遗传型转甲状腺素蛋白淀粉样变心肌病(ATTR-CM)成人患者。现在,CHMP的意见将递交至欧盟

2019年12月16日讯 /生物谷BIOON/ --制药巨头辉瑞(Pfizer)近日宣布,欧洲药品管理局(EMA)人用医药产品委员会(CHMP)已发布积极审查意见,推荐批准Vyndaqel(tafamidis),该药是一种每日一次的61mg口服胶囊,用于治疗野生型或遗传型转甲状腺素蛋白淀粉样变心肌病(ATTR-CM)成人患者。现在,CHMP的意见将递交至欧盟委员会(EC)审查,后者预计在未来几个月内做出最终审查决定。
ATTR-CM是一种罕见的危及生命的疾病,其特征是在心脏中积聚一种称为淀粉样蛋白的错误折叠蛋白,其定义为限制性心肌病和进行性心力衰竭。平均而言,患者在确诊后只能存活2-3.5年。如果获批,Vyndaqel将成为欧盟首个针对ATTR-CM的治疗药物。
2011年,欧盟批准了一种不同类型的Vyndaqel(tafamidis meglomene)20mg胶囊,用于治疗1期症状性多发性神经病(ATTR-PN)成人患者的甲状腺素淀粉样变性,以延缓周围神经功能损害。对于ATTR-CM,tafamidis 61mg胶囊相当于80mg的tafamidis meglomene剂量(4片20mg胶囊),是为了方便患者而开发的一种胶囊,以便每日服用一粒。这2款药物具有相同的活性成分tafamidis,但由于推荐剂量不同,不可相互替代。
在美国,Vyndaqel(tafamidis meglumine)和Vyndamax(tafamidis)于今年5月初获得FDA批准,成为首个也是唯一一个治疗ATTR-CM的药物。2款药物是首创的(first-in-class)转甲状腺素蛋白(transthyretin)稳定剂tafamidis的两种口服制剂。
辉瑞全球产品开发罕见病高级副总裁兼首席开发官Brenda Cooperstone医学博士表示:“CHMP对Vyndaqel治疗ATTR-CM的积极评价反映了我们对改善患有这种罕见致命疾病患者预后的坚定承诺。在ATTR-ACT中,Vyndaqel降低了野生型或遗传型疾病患者的死亡率和心血管相关住院频率。如果获得批准,Vyndaqel对于患者来说将代表着一个真正的突破。”
淀粉样变联盟(Amyloidosis Alliance)主席Jean-Christophe Fidalgo表示:“对于ATTR-CM患者而言,目前还没有有效的药物治疗方法。淀粉样变联盟赞同CHMP的意见,我们希望EC能迅速批准Vyndaqel用于ATTR-CM,以便患者能及时获得这种药物。”
Vyndaqel在欧盟治疗适应症扩展申请,基于关键性III期临床研究ATTR-ACT的数据,这是调查一种ATTR-CM药理学疗法方面第一个也是唯一一个成功完成的全球性、双盲、随机、安慰剂对照临床试验。该研究共入组了441例患者,包括变异型或遗传型ATTR-CM患者,以及野生型ATTR-CM患者(指不是遗传的,而是可能随年龄增长而发生的)。
主要分析结果显示,在30个月治疗期间:(1)与安慰剂相比,Vyndaqel(tafamidis meglomene)显著降低了野生型和遗传型ATTR-CM患者的全因死亡和心血管相关住院率(p=0.0006)。(2)与安慰剂组相比,Vyndaqel将全因死亡率和全因住院率分别降低30%(p=0.026)和32%(p<0.0001)。(3)与安慰剂相比,Vyndaqel降低了所有亚组(野生型,遗传型,NYHA-I、-II、-III功能分级)的全因死亡风险:野生型亚组(HR=0.71,95%CI:0.474-1.052)和遗传型亚组(HR=0.69,95%CI:0.408-1.167)中死亡风险分别降低29%和31%。(4)横跨野生型和遗传型亚组,与安慰剂相比,Vyndaqel使6分钟步行试验(6MWT)评价的患者活动能力和堪萨斯城心肌病问卷(KCCQ)评价的患者生活质量各个方面的降低表现出一致的减少。(5)研究中,Vyndaqel的耐受性良好,并与安慰剂具有可比的安全性。
该申请也基于来自游离酸类型的tafamidis 61mg的一项评估。ATTR-ACT的主要结果已在德国慕尼黑举行的2018年 ESC大会上公布,并于2018年8月在线发表于《新英格兰医学杂志》(NEJM)。
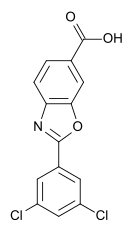
tafamidis分子结构(来自维基百科)
ATTR淀粉样变性是一种罕见的进行性疾病,其特征是由错误折叠的转甲状腺素蛋白组成的淀粉样沉积在人体器官和组织中的异常堆积。淀粉样变性可影响身体的许多器官和组织,包括外周神经系统,以及心脏、肾脏、胃肠道和眼睛等器官。ATTR-CM和ATTR-PN是该病的两种表现。
ATTR-CM是一种罕见的、致命的、严重诊断不足的疾病,与渐进性心力衰竭相关。ATTR-CM是由名为转甲状腺素蛋白(TTR)的转运蛋白不稳定而引起的,该转运蛋白由4个相同的亚单元(四聚体)组成。在ATTR-CM中,不稳定的四聚体解离时发生心力衰竭,导致错误折叠的蛋白质聚集成淀粉样纤维并主要沉积在心脏中。
tafamidis是一种口服小分子药物,可稳定TTR。在美国和欧盟,tafamidis于2011年被授予治疗ATTR-CM的孤儿药资格。在2017年,FDA还授予了tafamidis快速通道地位;2018年3月,日本卫生劳动福利部(MHLW)授予tafamidis SAKIGAKE资格;2018年5月,FDA授予了tafamidis突破性药物资格。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->