未来人类真能利用粪便治疗抑郁症吗?
来源:本站原创 2019-09-11 15:12
试想一下,未来人类竟能利用粪便来治疗抑郁症了!最近,一篇发表在国际杂志Microbiome上的研究报告中[1],来自东南大学医学院姚红红教授课题组通过研究发现,机体肠道菌群的变化可能导致抑郁症的发生,而通过菌群移植或许就能显著改善患者的抑郁样症状。NLRP3敲除后的肠道菌群如何影响机体的抑郁症样行为图片来源:Yuan Zhang et al. doi:10.1186/s40168-019-0733
试想一下,未来人类竟能利用粪便来治疗抑郁症了!最近,一篇发表在国际杂志Microbiome上的研究报告中[1],来自东南大学医学院姚红红教授课题组通过研究发现,机体肠道菌群的变化可能导致抑郁症的发生,而通过菌群移植或许就能显著改善患者的抑郁样症状。

NLRP3敲除后的肠道菌群如何影响机体的抑郁症样行为
图片来源:Yuan Zhang et al. doi:10.1186/s40168-019-0733-3
严重抑郁障碍(MDD,Major depressive disorder)是一种全球范围内最常见的精神性疾病,其主要特点为情绪功能障碍,是遗传因素和环境因素共同作用引发的一种疾病;此前有多项研究理论解释了MDD的病理学机制,但尚无一种明确的解释,如今越来越多的研究证据表明,肠道菌群是一种关键的环境因素,其能通过微生物菌群-肠道-大脑轴来重塑机体大脑,肠道菌群发生改变的小鼠常常会表现出抑郁症相关的行为,而且抑郁症患者和动物模型机体中肠道菌群的组成也会发生改变,研究者发现,将MDD患者的肠道菌群移植到无菌小鼠机体中就会使其出现抑郁症行为,而且将抑郁症患者的肠道菌群移植到接受抗生素疗法的大鼠体内也会使其出现抑郁症行为,相关研究结果就提示,肠道菌群组成的改变或是引发抑郁症的重要因素,目前研究人员并不清楚肠道菌群影响机体抑郁症样行为的分子机制。
根据抑郁症炎性小体假说,神经炎性通路在MDD发生过程中扮演着非常关键的角色,抑郁症患者机体血细胞中半胱氨酸天冬氨酸酶-1(Caspase-1)和NLRP3 mRNA的水平会增加,这就表明,炎性小体或是抑郁症发生的关键介导子,而近来有研究认为,NLRP3是抑郁症发生的共同介导子,其在抑郁症患者和啮齿类动物模型中会被激活,更有意思的是,敲除Caspase-1会引发抑郁症样行为的下降,而且Caspase-1抑制剂—米诺环素能通过调节压力与肠道菌群组成之间的关系来改善抑郁症样行为,目前研究人员并不清楚炎性小体和肠道菌群之间的关联。circRNAs是一种在大脑中高度表达的环状RNA,其主要参与生理性和病理性过程的调节,此前研究人员发现,环状RNA HIPK2(circHIPK2)能够抑制大脑中星形胶质细胞的激活,基于星形胶质细胞在抑郁症患者大脑中会表现出功能异常以及circHIPK2在星形胶质细胞激活中扮演的角色,研究人员推测,在抑郁症状况下,肠道菌群的改变能够通过circHIPK2调节的星形胶质细胞的功能来部分影响个体的行为。
这项研究中,姚红红教授等人通过研究比较了野生型和NLRP3被敲除的同窝出生的小鼠鼠崽机体肠道菌群的差异,他们想以此评估是否肠道菌群的改变与抑郁症样行为之间存在一定关联,同时研究者还想知道NLRP3敲除的小鼠机体的肠道菌群如何影响遭受慢性压力的小鼠机体的行为,尤其是肠道菌群是否是通过调节circRNAs来促进星形胶质细胞功能的关键因素。研究者发现,敲除NLRP3基因的小鼠与野生型同窝小鼠相比会表现出显著的抑郁样行为差异,并且它们的肠道微生物群的组成显著改变,提示这种行为的差异很有可能是肠道菌群的变化引起的,同时NLRP3炎性小体的缺失会影响小鼠肠道菌群的组成,NLRP3敲除的小鼠机体的运动活性显著高于野生型小鼠,而且NLRP3敲除的小鼠的肠道菌群的共存和移植还能避免敲除NLRP3对小鼠一般运动功能的影响;与此同时研究者还发现,移植NLRP3被敲除后的小鼠机体的肠道菌群就能够减缓慢性压力所诱导的小鼠机体的抑郁症行为。
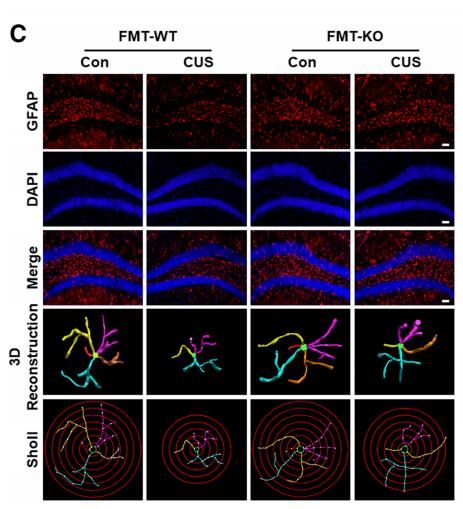
移植NLRP3被敲除后的肠道菌群对星形胶质细胞异常功能的影响效应
图片来源:Yuan Zhang et al. doi:10.1186/s40168-019-0733-3
研究者表示,NLRP3敲除小鼠和野生型小鼠机体中肠道菌群的组成存在明显差异,主要表现为厚壁菌门、变形菌门和拟杆菌相对丰都的差异,利用NLRP3敲除小鼠肠道菌群进行的粪便微生物移植(FMT)能够显著减缓慢性压力小鼠机体的抑郁症样行为,由于circHIPK与抑郁症之间存在一定关联,而且观察结果发现,相比对照组而言,circHIPK的表达水平在慢性压力小鼠机体中会明显增加,后期研究者还需要进一步深入研究,研究者指出,FMT或能通过抑制circHIPK的表达来改善经历慢性压力小鼠机体中星形胶质细胞的功能异常。
这项研究中,研究人员阐明了抑郁症个体中肠道菌群-circHIPK-星形胶质细胞轴的存在,并提供了新的研究证据表明,移植来自NLRP3敲除的小鼠机体的肠道菌群或有望作为一种治疗抑郁症的新型疗法。我们都知道,抑郁症是一种情感障碍性疾病,其发病因素主要由社会、环境和个体三方面决定,这类疾病具有高发病率,高复发率,高致残率和高自杀率等特点,位居全球疾病总负担第二位。目前,治疗抑郁症主要是围绕单胺类神经递质学说开发的抗抑郁药物,但这类药物存在着起效慢、效率低等缺点,很多患者会出现多种不良反应,而肠道菌群治疗的有效率和安全性明显高于这些药物。
近年来,很多科学家们都发现抑郁症的发生都与机体肠道菌群有关,比如此前一项刊登在国际杂志Nture Microbiology上的研究报告中[2],来自爱尔兰大学等机构的科学家们就通过研究发现了抑郁症与人类肠道菌群的微妙关系,研究人员发现,与正常受试者相比,患有抑郁症的受试者的微生物组中缺少两种肠道微生物,即 粪球菌属细菌(Coprococcus)和小类杆菌属细菌(Dialister),当有年龄、性别或抗抑郁药等因素影响微生物组时,这一研究结果仍然成立。后期研究人员还会进行大量研究来阐明抑郁症与肠道菌群之间的神秘关联,而未来利用肠道菌群治疗抑郁症等神经性疾病或许也将成为新的研究方向。
参考资料:
【1】Yuan Zhang, Rongrong Huang, Mengjing Cheng, et al. Gut microbiota from NLRP3-deficient mice ameliorates depressive-like behaviors by regulating astrocyte dysfunction via circHIPK2, Microbiome (2019) doi:10.1186/s40168-019-0733-3
【2】Mireia Valles-Colomer, Gwen Falony, Youssef Darzi, et al. The neuroactive potential of the human gut microbiota in quality of life and depression, Nature Microbiology volume 4, pages623–632 (2019) doi:10.1038/s41564-018-0337-x
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


