造血干细胞研究进展(第4期)
- AIBP
- Cas12a
- Cas9
- CRISPR
- Ragnase-1
- TET2
- T细胞
- β-地中海贫血
- 基因疗法
- 基因编辑
- 巨噬细胞
- 海绵状凝胶
- 维生素B3
- 胆固醇
- 血细胞
- 造血干细胞
- 镰状细胞病
- 骨髓移植
来源:本站原创 2019-04-27 18:46
2019年4月27日讯/生物谷BIOON/---造血干细胞(hemapoietic stem cell, HSC)是存在于造血组织中的一群原始造血细胞,它不是组织固定细胞,可存在于造血组织及血液中。造血干细胞在人胚胎2周时可出现于卵黄囊,妊娠5个月后,骨髓开始造血,出生后骨髓成为干细胞的主要来源。在造血组织中,所占比例甚少。现代医学中,造血干细胞在骨髓移植和疾病治疗方面有重要作用。1988年法国的
2019年4月27日讯/生物谷BIOON/---造血干细胞(hemapoietic stem cell, HSC)是存在于造血组织中的一群原始造血细胞,它不是组织固定细胞,可存在于造血组织及血液中。造血干细胞在人胚胎2周时可出现于卵黄囊,妊娠5个月后,骨髓开始造血,出生后骨髓成为干细胞的主要来源。在造血组织中,所占比例甚少。现代医学中,造血干细胞在骨髓移植和疾病治疗方面有重要作用。
1988年法国的Gluckman教授在国际上率先成功采用脐血造血干细胞移植,救治了一名贫血患儿,标志着脐带血造血干细胞移植时代的开启。全球现每年约进行6万例骨髓移植术,其中使用自体和同种异体造血干细胞完成骨髓移植术的患者人数分别为近3.5万和2.5万例。
造血干细胞的来源主要包括骨髓、外周血和脐带血。如今,“骨髓移植”已渐渐被“外周血造血干细胞移植”代替。也就是说,现在捐赠骨髓已不再抽取骨髓,而只是“献血”了。 脐带血是胎儿娩出断脐后残留在脐带和胎盘中的血液,富含造血干细胞,可用于治疗急、慢性白血病和某些恶性肿瘤等多种重大疾病。
基于此,小编针对近年来造血干细胞研究取得的进展进行一番梳理,以飨读者。
1.Blood:利用CRISPR-Cas12a基因编辑有望治疗β-地中海贫血
doi:10.1182/blood-2019-01-895094
根据世界卫生组织(WHO)的统计,镰状细胞病和β-地中海贫血每年在世界范围内共影响33.2万人怀孕或分娩。这两种疾病都涉及β珠蛋白编码基因发生突变。在β-地中海贫血中,突变阻止红细胞产生足够多的携氧血红蛋白分子,从而导致贫血。在镰状细胞病中,突变导致血红蛋白改变形状,使得红细胞变形为僵硬的“镰刀”形状,从而阻塞血管。
在一项新的研究中,来自美国达纳法伯癌症研究所、波士顿儿童医院和马萨诸塞大学医学院等研究机构的研究人员通过将CRISPR-Cas12a基因编辑应用于患者自己的造血干细胞中,开发出一种治疗一种最为常见的遗传性血液疾病---β-地中海贫血---的策略。这种方法克服了之前的技术挑战,而且要比过去更有效地对造血干细胞进行编辑。相关研究结果近期发表在Blood期刊上,论文标题为“Editing aberrant splice sites efficiently restores β-globin expression in β-thalassemia”。论文第一作者为Shuqian Xu。论文通讯作者为Daniel Bauer博士和Scot Wolfe博士。

这新的研究发现这些经过基因编辑的造血干细胞产生得到基因校正的红细胞,因而能够产生功能性的血红蛋白。
在这项新的研究中,这些研究人员使用一种类似于CRISPR-Cas9的基因编辑方案来靶向涉及剪接突变---在β-珠蛋白编码基因附近的DNA片段出现差错改变读取这个基因以组装β-珠蛋白的方式---的β-地中海贫血形式。9名β地中海贫血患者捐献了他们的造血干细胞,这样就可在培养皿中操纵它们。对于其中的一些患者,这些研究人员利用另一种不同的酶--- Cas12a---来更高效地靶向这些突变。CRISPR/Cas12a高效地进行基因编辑并恢复了来自每名患者的血细胞中β-珠蛋白编码基因的正常剪接。
2.Nat Med:优化的CRISPR-Cas9基因编辑有望治疗镰状细胞病
doi:10.1038/s41591-019-0401-y
在一项新的研究中,来自美国达纳法伯癌症研究所、波士顿儿童医院和马萨诸塞大学医学院等研究机构的研究人员通过将CRISPR-Cas9基因编辑应用于患者自己的造血干细胞中,开发出一种治疗一种最为常见的遗传性血液疾病---镰状细胞病(sickle cell disease)---的策略。这种方法克服了之前的技术挑战,而且要比过去更有效地对造血干细胞进行编辑。相关研究结果于2019年3月25日在线发表在Nature Medicine期刊上,论文标题为“Highly efficient therapeutic gene editing of human hematopoietic stem cells”。论文通讯作者为Daniel Bauer博士,论文第一作者为Yuxuan Wu和Jing Zeng。
这项新的研究使用了CRISPR-Cas9技术,特别是马萨诸塞大学医学院的Scot Wolfe博士领导的一个研究团队进行基因修饰过的Cas9蛋白,来优化基因编辑。在之前对人造血干/祖细胞的基因组进行编辑的尝试中,一旦将这些基因编辑的细胞植入骨髓中,基因编辑的效率、特异性和长期稳定性就会发生变化。这种新技术提高了基因编辑的靶向性和持久性。
之前在波士顿儿童医院的研究已表明,让一种名为BCL11A的基因失活允许红细胞即便在出生后也会继续产生胎儿形式的血红蛋白。胎儿血红蛋白不会产生镰刀形状,能够代替有缺陷的“成年”血红蛋白。最近,Bauer发现了一个更安全的靶标:BCL11A基因的增强子,仅在红细胞中有活性。
Bauer说,“通过使用我们开发的这种新型的非常有效的方法,我们能够在我们收集的几乎所有的造血干细胞中对BCL11A的增强子进行编辑,从而克服了对这些细胞进行基因编辑所面临的一些技术挑战。在我们的实验中,95%以上的增强子序列拷贝以我们期望的治疗方式发生改变。”
这种策略使得携带来自镰状细胞病患者的造血干细胞的小鼠能够产生具有足够的胎儿血红蛋白的红细胞,从而阻止红细胞产生镰刀形状。Bauer团队发现这些经过基因编辑的造血干细胞在移植到骨髓中后产生得到基因校正的红细胞。随后,当从这些小鼠中分离出造血干细胞并移植到其他小鼠中时,这些造血干细胞再次定植并且仍然携带治疗性的基因变化。
3.Science:中美科学家揭示AIBP介导的胆固醇外流调节造血干细胞的命运
doi:10.1126/science.aav1749
在一项新的研究中,中国中南大学湘雅医院老年病科的柏勇平(Yongping Bai)课题组、美国休斯敦卫理公会研究所的Longhou Fang团队和Kaifu Chen团队报道作为一种体节源性促造血信号分子,AIBP协调HSPC在造血内皮(hemogenic endothelium)中产生,其中造血内皮是一类展现出造血潜能的特殊内皮。从机制上讲,AIBP调节的胆固醇外流激活内皮中参与胆固醇生物合成的一种称为Srebp2的主转录因子,这接着反式激活Notch和促进造血干/祖细胞(hematopoietic stem/progenitor cell, HSPC)产生。相关研究结果于2019年1月31日在线发表在Science期刊上,论文标题为“AIBP-mediated cholesterol efflux instructs hematopoietic stem and progenitor cell fate”。

在进一步的实验中,这些研究人员证实抑制Srebp2会破坏高胆固醇血症诱导的HSPC增殖。他们还发现Srebp2活化和Notch上调与高胆固醇血症患者中的HSPC增殖存在关联性。通过采用多种测序技术---全基因组CHIP-seq、RNA-seq和ATAC-seq,他们证实Srebp2反式调节造血功能所必需的Notch通路基因。
综上所述,这些研究结果概述了一种受到AIBP调节的依赖于Srebp2的胆固醇代谢通路,它控制着发育中的HSPC产生和动脉粥样硬化性心血管疾病中的HSPC增殖。这些新的见解可能对血液疾病和心血管疾病的治疗产生重大影响。
4.Genome Res:TET2基因突变对血红细胞成熟的影响
doi:10.1101/gr.239277.118
在静脉中,干细胞不断成熟并发育成不同的血细胞,这是身体正常工作所必需的。如今,在一项新的研究中,哥本哈根大学和海德堡EMBL的研究人员已经确切地发现了血液中干细胞的特定突变如何阻碍这种成熟过程。他们展示了当TET2基因被抑制时,小鼠血细胞在分子水平上会发生什么(许多患有白血病和其他疾病的患者通常具有TET2突变)。研究结果发表在《Genome Research》杂志上。
研究人员研究了TET2基因突变小鼠血细胞的DNA信息。他们使用超现代基因测序技术绘制分子和遗传修饰图。他们同时测量了1000多种有助于干细胞发育成功能细胞的转录因子。通过这种方式,研究人员可以确切地确定哪些基因受到TET2损失的影响。
了解TET2突变如何导致白血病具有巨大潜力。这种知识是开发有效治疗白血病的新药的重要一步,因为我们经常在疾病发作之前在白血病患者中发现这种突变。这可以使治疗成为可能。
5.Cell Stem Cell:维生素B3同系物帮助产生血细胞
doi:10.1016/j.stem.2019.02.012
科学家们已经知道压力会导致造血干细胞分裂变慢,从而导致血液细胞的供应不足。从生物学上讲,压力会引起线粒体活动的增加。为了满足再生血液细胞的高需求,造血干细胞的线粒体中一个叫做氧化磷酸化的反应会增加,从而给细胞供能,但是这会带来问题:增强线粒体的活动会导致造血干细胞提前衰老。
一组由瑞士洛桑联邦理工学院(école Polytechnique Fédérale de Lausanne,EPFL)的Olaia Naveiras和瑞士洛桑的路德维希癌症研究所(Ludwig Institute for Cancer Research)的Nicola Vannini领导的研究团队最近发现了一种维生素B3的同系物(烟酰胺核糖)可以增加造血干细胞的活性。这项研究对干细胞治疗有着深远的影响,尤其是日常补充剂摄入的烟酰胺核糖也有这种效应。
研究人员发现人和小鼠的造血干细胞接触烟酰胺核糖后功能会增强,线粒体循环能力也会增强,这有助于清除损伤的线粒体以产生新的线粒体。他们发现将烟酰胺核糖加入到接受辐照以清除血液细胞的小鼠的饮食中可以将小鼠的生存率提高80%,加速它们的血液恢复,同时烟酰胺核糖还可以增加免疫缺陷小鼠产生白细胞。这意味着造血干细胞分裂和产生新的血液细胞的能力显著增强。
6.Nat Commun:揭示调节造血干祖细胞分化更新的新型分子机制
doi:10.1038/s41467-019-09028-w
近日,来自大阪大学的科学家们通过研究发现,一种名为Ragnase-1的分子或能调节造血干祖细胞(HSPCs,hematopoietic stem and progenitor cells)的更新和分化,所有血细胞都衍生自HSPCs,相关研究结果刊登于国际杂志Nature Communications上;文章中研究者揭示了Ragnase-1分子的异常如何失去调节血细胞产生的能力,以及其如何引发多种副作用发生,比如血液恶性肿瘤的发生等。
这项研究中,研究人员首次利用基于计算机的分析技术鉴别出了在成体和胚胎HSPCs表达发生明显不同的关键基因,在这些基因中,研究人员选择Ragnase-1进行深入分析研究,鉴于其在另一种干细胞类型分化过程中所扮演的角色,后期研究人员进行的分析包括在小鼠机体中剔除一个或一对Ragnase-1基因拷贝,随后评估干细胞分化为其它血细胞系的影响以及小鼠整体健康程度的影响。
研究者Nobuyuki Takakura说道,剔除Ragnase-1基因(甚至是一个基因拷贝)或会导致骨髓中HSPCs分化和更新发生异常,同时Ragnase-1基因敲除的小鼠也会表现出一些生理学的异常,比如体重减轻和脾脏扩大等,这些小鼠往往在很年轻时就死亡了。随后研究者深入分析了Ragnase-1促进其功能发挥的机制,他们发现,Ragnase-1能通过降解靶点mRNAs:Gata2和Tal1来在转录后水平上施加调节活性,这一过程对于控制血细胞生成至关重要。
7.Nat Biotechnol:可注射的海绵状凝胶促进T细胞再生
doi:10.1038/s41587-019-0017-2
如今,在一项新的研究中,来自美国哈佛大学的研究人员开发出一种可注射的海绵状凝胶,可增强骨髓移植后的T细胞产生,从而增加了免疫系统中的这些关键组分的数量和多样性。这种生物工程支架(即海绵状凝胶)可在骨髓移植的同时注射到皮肤下,从而有助于在接受移植后恢复免疫系统。相关研究结果于2019年2月11日在线发表在Nature Biotechnology期刊上,论文标题为“An injectable bone marrow–like scaffold enhances T cell immunity after hematopoietic stem cell transplantation”。论文通讯作者为哈佛大学干细胞研究所联合主任David Scadden教授和哈佛大学工程与应用科学学院生物工程教授David Mooney。
利用Mooney实验室在用于提供细胞指导性线索的生物材料开发方面的开拓性研究成果,这些研究人员设计了一种具有允许细胞进出的大孔的海绵状凝胶。这种凝胶具有两种内置的蛋白:第一种蛋白招募外部细胞,第二种蛋白促进T细胞祖细胞(T-cell progenitor)产生。第一种蛋白称为骨形态发生蛋白2(BMP2),招募局部的细胞并促进它们变成骨细胞。一旦这种凝胶类似于血管化的骨髓,第二种蛋白就促进生活在这种生物工程支架中的造血干细胞产生T细胞祖细胞。
当这些研究人员在接受造血干细胞移植的小鼠中测试这种生物工程支架时,他们发现相比于没有接受这种支架注射的小鼠,接受这种注射的小鼠更快地产生T细胞。
论文第一作者、哈佛大学工程与应用科学学院前博士后研究员Nisarg Shah说,“我们还发现我们不仅提高了在造血干细胞移植后这些T细胞形成的速度,而且还增加了所形成的T细胞类型的多样性。因此,我们不仅在改善T细胞的数量,而且还潜在地改善病原体识别和保护的广度。”
8.Cell Stem Cell:基因疗法可以用于治疗致命性自体免疫疾病
doi:10.1016/j.stem.2018.12.003
最近,加州大学洛杉矶分校研究人员创造了一种修复血液干细胞的基因突变的方法,以逆转导致威胁生命的自身免疫综合症(称为IPEX)的发生。这项工作在发表在最近的《Cell Stem Cell》杂志上。
IPEX是由一种突变引起的自身免疫疾病。该突变阻止了一种名为FoxP3的基因的表达,从而导致产生血液干细胞分化形成调节性T细胞的功能受到了阻碍。调节性T细胞可以负向控制身体的免疫系统的活性。缺少这一类细胞的话,免疫系统会攻击身体自身的组织和器官,最终导致自身免疫疾病的发生。
在这项新研究中,加州大学洛杉矶分校的研究人员使用病毒载体将FoxP3基因的正常拷贝传递到小鼠血液干细胞的基因组中,从而产生功能性调节性T细胞。在研究后不久,研究中的所有小鼠几乎没有IPEX症状。
9.PNAS:骨髓移植后干细胞是否会正常发挥功能?
doi:10.1073/pnas.1801480116
骨髓移植手术通过移植健康的血液干细胞,为许多类型的癌症,血液疾病和免疫疾病提供最佳治疗。在老鼠身上进行的一项新的研究表明:成功移植的干细胞并不会表现的像在供体体内一样。。相反,放射和高剂量化学疗法似乎会导致新移植的细胞产生“极端行为”。该研究结果于1月8日刊登在《PNAS》杂志上。

在一系列实验中,研究人员了解到,当移植到受辐射的小鼠中时,只有极少数干细胞会产生血液和免疫细胞,而许多其他干细胞则会变成休眠状态,什么都不做。此外,辐射后,这一小撮“活跃状态”的干细胞也变得偏向于仅产生某些类型的免疫细胞。然而,整体血液和免疫系统仍然趋于保持平衡。在没有经历辐射的小鼠中,除T细胞外,所有干细胞对血液和免疫系统的贡献相同,这表明用于确保成功移植的预处理(放疗,化疗)是细胞行为异常的原因。
10.Cell Stem Cell:震惊!高达10%的人体血细胞来自肠道中的造血干细胞库
doi:10.1016/j.stem.2018.11.007
科学家们之前曾认为血细胞是一群特殊的造血干细胞在骨骼中专门产生的。然而,在一项新的研究中,来自美国哥伦比亚大学瓦格洛斯内外科医生学会的研究人员吃惊地发现人体肠道可能利用它自身的造血干细胞库提供高达10%的用于人体循环的血细胞。相关研究结果于2018年10月29日在线发表在Cell Stem Cell期刊上,论文标题为“Human Intestinal Allografts Contain Functional Hematopoietic Stem and Progenitor Cells that Are Maintained by a Circulating Pool”。论文通讯作者为哥伦比亚大学的Megan Sykes。
当这些研究人员注意到接受肠道移植的患者的血液含有来自供者的血细胞时,他们发现了肠道中的造血干细胞库。他们追踪到这些供者血细胞的来源:供者肠道中的造血干细胞。
来自供者肠道的造血干细胞产生的血细胞也可能对移植受者有益。患者体内循环的供者血细胞越多,发生排斥肠道移植物的可能性就越小。
Sykes说,“携带着高水平供者细胞的患者可能不像当前这样需要那么多的免疫抑制药物,而且减少免疫抑制药物剂量可能改善治疗结果。”
11.Nature:中科院潘巍峻课题组揭示一类巨噬细胞引导造血干细胞归巢机制
doi:10.1038/s41586-018-0709-7
在一项新的研究中,中国科学院上海营养与健康研究院研究员潘巍峻(Weijun Pan)及其团队利用先进的实时成像和一种细胞标记系统,对斑马鱼尾部造血组织(相当于哺乳动物的胚胎肝脏)中的造血干细胞归巢进行高分辨率分析,并揭示出血管结构在调节造血干细胞归巢到壁龛微环境中的作用。相关研究结果于2018年11月19日在线发表在Nature期刊上,论文标题为“VCAM-1+ macrophages guide the homing of HSPCs to a vascular niche”。
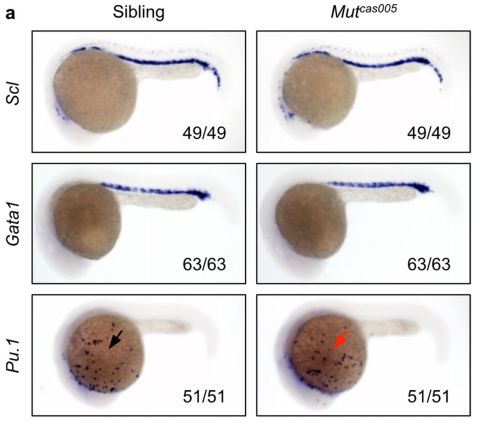
潘巍峻团队鉴定出一种称为VCAM-1+巨噬细胞的壁龛细胞群体在静脉丛(venous plexus)的内表面上巡逻,以一种依赖于ITGA4的方式与造血干细胞相互作用,并指导造血干细胞归巢到壁龛微环境中。这些称为先导细胞(usher cell)的细胞与尾静脉毛细血管和静脉丛一起确定了造血干细胞在壁龛微环境中的归巢热点区域。
更重要的是,这些先导细胞在归巢热点区域附近巡逻,一旦发现造血干细胞来临时,就将它们引导到特定的血管结构中,从而实现造血干细胞归巢到壁龛微环境中。
总之,这项研究提供了关于造血干细胞归巢机制的新见解,并揭示出具有巡逻行为的VCAM-1 +巨噬细胞群体在造血干细胞归巢中发挥着重要的作用。(生物谷 Bioon.com)
1988年法国的Gluckman教授在国际上率先成功采用脐血造血干细胞移植,救治了一名贫血患儿,标志着脐带血造血干细胞移植时代的开启。全球现每年约进行6万例骨髓移植术,其中使用自体和同种异体造血干细胞完成骨髓移植术的患者人数分别为近3.5万和2.5万例。
造血干细胞的来源主要包括骨髓、外周血和脐带血。如今,“骨髓移植”已渐渐被“外周血造血干细胞移植”代替。也就是说,现在捐赠骨髓已不再抽取骨髓,而只是“献血”了。 脐带血是胎儿娩出断脐后残留在脐带和胎盘中的血液,富含造血干细胞,可用于治疗急、慢性白血病和某些恶性肿瘤等多种重大疾病。
基于此,小编针对近年来造血干细胞研究取得的进展进行一番梳理,以飨读者。
1.Blood:利用CRISPR-Cas12a基因编辑有望治疗β-地中海贫血
doi:10.1182/blood-2019-01-895094
根据世界卫生组织(WHO)的统计,镰状细胞病和β-地中海贫血每年在世界范围内共影响33.2万人怀孕或分娩。这两种疾病都涉及β珠蛋白编码基因发生突变。在β-地中海贫血中,突变阻止红细胞产生足够多的携氧血红蛋白分子,从而导致贫血。在镰状细胞病中,突变导致血红蛋白改变形状,使得红细胞变形为僵硬的“镰刀”形状,从而阻塞血管。
在一项新的研究中,来自美国达纳法伯癌症研究所、波士顿儿童医院和马萨诸塞大学医学院等研究机构的研究人员通过将CRISPR-Cas12a基因编辑应用于患者自己的造血干细胞中,开发出一种治疗一种最为常见的遗传性血液疾病---β-地中海贫血---的策略。这种方法克服了之前的技术挑战,而且要比过去更有效地对造血干细胞进行编辑。相关研究结果近期发表在Blood期刊上,论文标题为“Editing aberrant splice sites efficiently restores β-globin expression in β-thalassemia”。论文第一作者为Shuqian Xu。论文通讯作者为Daniel Bauer博士和Scot Wolfe博士。

这新的研究发现这些经过基因编辑的造血干细胞产生得到基因校正的红细胞,因而能够产生功能性的血红蛋白。
在这项新的研究中,这些研究人员使用一种类似于CRISPR-Cas9的基因编辑方案来靶向涉及剪接突变---在β-珠蛋白编码基因附近的DNA片段出现差错改变读取这个基因以组装β-珠蛋白的方式---的β-地中海贫血形式。9名β地中海贫血患者捐献了他们的造血干细胞,这样就可在培养皿中操纵它们。对于其中的一些患者,这些研究人员利用另一种不同的酶--- Cas12a---来更高效地靶向这些突变。CRISPR/Cas12a高效地进行基因编辑并恢复了来自每名患者的血细胞中β-珠蛋白编码基因的正常剪接。
2.Nat Med:优化的CRISPR-Cas9基因编辑有望治疗镰状细胞病
doi:10.1038/s41591-019-0401-y
在一项新的研究中,来自美国达纳法伯癌症研究所、波士顿儿童医院和马萨诸塞大学医学院等研究机构的研究人员通过将CRISPR-Cas9基因编辑应用于患者自己的造血干细胞中,开发出一种治疗一种最为常见的遗传性血液疾病---镰状细胞病(sickle cell disease)---的策略。这种方法克服了之前的技术挑战,而且要比过去更有效地对造血干细胞进行编辑。相关研究结果于2019年3月25日在线发表在Nature Medicine期刊上,论文标题为“Highly efficient therapeutic gene editing of human hematopoietic stem cells”。论文通讯作者为Daniel Bauer博士,论文第一作者为Yuxuan Wu和Jing Zeng。
这项新的研究使用了CRISPR-Cas9技术,特别是马萨诸塞大学医学院的Scot Wolfe博士领导的一个研究团队进行基因修饰过的Cas9蛋白,来优化基因编辑。在之前对人造血干/祖细胞的基因组进行编辑的尝试中,一旦将这些基因编辑的细胞植入骨髓中,基因编辑的效率、特异性和长期稳定性就会发生变化。这种新技术提高了基因编辑的靶向性和持久性。
之前在波士顿儿童医院的研究已表明,让一种名为BCL11A的基因失活允许红细胞即便在出生后也会继续产生胎儿形式的血红蛋白。胎儿血红蛋白不会产生镰刀形状,能够代替有缺陷的“成年”血红蛋白。最近,Bauer发现了一个更安全的靶标:BCL11A基因的增强子,仅在红细胞中有活性。
Bauer说,“通过使用我们开发的这种新型的非常有效的方法,我们能够在我们收集的几乎所有的造血干细胞中对BCL11A的增强子进行编辑,从而克服了对这些细胞进行基因编辑所面临的一些技术挑战。在我们的实验中,95%以上的增强子序列拷贝以我们期望的治疗方式发生改变。”
这种策略使得携带来自镰状细胞病患者的造血干细胞的小鼠能够产生具有足够的胎儿血红蛋白的红细胞,从而阻止红细胞产生镰刀形状。Bauer团队发现这些经过基因编辑的造血干细胞在移植到骨髓中后产生得到基因校正的红细胞。随后,当从这些小鼠中分离出造血干细胞并移植到其他小鼠中时,这些造血干细胞再次定植并且仍然携带治疗性的基因变化。
3.Science:中美科学家揭示AIBP介导的胆固醇外流调节造血干细胞的命运
doi:10.1126/science.aav1749
在一项新的研究中,中国中南大学湘雅医院老年病科的柏勇平(Yongping Bai)课题组、美国休斯敦卫理公会研究所的Longhou Fang团队和Kaifu Chen团队报道作为一种体节源性促造血信号分子,AIBP协调HSPC在造血内皮(hemogenic endothelium)中产生,其中造血内皮是一类展现出造血潜能的特殊内皮。从机制上讲,AIBP调节的胆固醇外流激活内皮中参与胆固醇生物合成的一种称为Srebp2的主转录因子,这接着反式激活Notch和促进造血干/祖细胞(hematopoietic stem/progenitor cell, HSPC)产生。相关研究结果于2019年1月31日在线发表在Science期刊上,论文标题为“AIBP-mediated cholesterol efflux instructs hematopoietic stem and progenitor cell fate”。

图片来自Science, 2019, doi:10.1126/science.aav1749。
在进一步的实验中,这些研究人员证实抑制Srebp2会破坏高胆固醇血症诱导的HSPC增殖。他们还发现Srebp2活化和Notch上调与高胆固醇血症患者中的HSPC增殖存在关联性。通过采用多种测序技术---全基因组CHIP-seq、RNA-seq和ATAC-seq,他们证实Srebp2反式调节造血功能所必需的Notch通路基因。
综上所述,这些研究结果概述了一种受到AIBP调节的依赖于Srebp2的胆固醇代谢通路,它控制着发育中的HSPC产生和动脉粥样硬化性心血管疾病中的HSPC增殖。这些新的见解可能对血液疾病和心血管疾病的治疗产生重大影响。
4.Genome Res:TET2基因突变对血红细胞成熟的影响
doi:10.1101/gr.239277.118
在静脉中,干细胞不断成熟并发育成不同的血细胞,这是身体正常工作所必需的。如今,在一项新的研究中,哥本哈根大学和海德堡EMBL的研究人员已经确切地发现了血液中干细胞的特定突变如何阻碍这种成熟过程。他们展示了当TET2基因被抑制时,小鼠血细胞在分子水平上会发生什么(许多患有白血病和其他疾病的患者通常具有TET2突变)。研究结果发表在《Genome Research》杂志上。
研究人员研究了TET2基因突变小鼠血细胞的DNA信息。他们使用超现代基因测序技术绘制分子和遗传修饰图。他们同时测量了1000多种有助于干细胞发育成功能细胞的转录因子。通过这种方式,研究人员可以确切地确定哪些基因受到TET2损失的影响。
了解TET2突变如何导致白血病具有巨大潜力。这种知识是开发有效治疗白血病的新药的重要一步,因为我们经常在疾病发作之前在白血病患者中发现这种突变。这可以使治疗成为可能。
5.Cell Stem Cell:维生素B3同系物帮助产生血细胞
doi:10.1016/j.stem.2019.02.012
科学家们已经知道压力会导致造血干细胞分裂变慢,从而导致血液细胞的供应不足。从生物学上讲,压力会引起线粒体活动的增加。为了满足再生血液细胞的高需求,造血干细胞的线粒体中一个叫做氧化磷酸化的反应会增加,从而给细胞供能,但是这会带来问题:增强线粒体的活动会导致造血干细胞提前衰老。
一组由瑞士洛桑联邦理工学院(école Polytechnique Fédérale de Lausanne,EPFL)的Olaia Naveiras和瑞士洛桑的路德维希癌症研究所(Ludwig Institute for Cancer Research)的Nicola Vannini领导的研究团队最近发现了一种维生素B3的同系物(烟酰胺核糖)可以增加造血干细胞的活性。这项研究对干细胞治疗有着深远的影响,尤其是日常补充剂摄入的烟酰胺核糖也有这种效应。
研究人员发现人和小鼠的造血干细胞接触烟酰胺核糖后功能会增强,线粒体循环能力也会增强,这有助于清除损伤的线粒体以产生新的线粒体。他们发现将烟酰胺核糖加入到接受辐照以清除血液细胞的小鼠的饮食中可以将小鼠的生存率提高80%,加速它们的血液恢复,同时烟酰胺核糖还可以增加免疫缺陷小鼠产生白细胞。这意味着造血干细胞分裂和产生新的血液细胞的能力显著增强。
6.Nat Commun:揭示调节造血干祖细胞分化更新的新型分子机制
doi:10.1038/s41467-019-09028-w
近日,来自大阪大学的科学家们通过研究发现,一种名为Ragnase-1的分子或能调节造血干祖细胞(HSPCs,hematopoietic stem and progenitor cells)的更新和分化,所有血细胞都衍生自HSPCs,相关研究结果刊登于国际杂志Nature Communications上;文章中研究者揭示了Ragnase-1分子的异常如何失去调节血细胞产生的能力,以及其如何引发多种副作用发生,比如血液恶性肿瘤的发生等。
这项研究中,研究人员首次利用基于计算机的分析技术鉴别出了在成体和胚胎HSPCs表达发生明显不同的关键基因,在这些基因中,研究人员选择Ragnase-1进行深入分析研究,鉴于其在另一种干细胞类型分化过程中所扮演的角色,后期研究人员进行的分析包括在小鼠机体中剔除一个或一对Ragnase-1基因拷贝,随后评估干细胞分化为其它血细胞系的影响以及小鼠整体健康程度的影响。
研究者Nobuyuki Takakura说道,剔除Ragnase-1基因(甚至是一个基因拷贝)或会导致骨髓中HSPCs分化和更新发生异常,同时Ragnase-1基因敲除的小鼠也会表现出一些生理学的异常,比如体重减轻和脾脏扩大等,这些小鼠往往在很年轻时就死亡了。随后研究者深入分析了Ragnase-1促进其功能发挥的机制,他们发现,Ragnase-1能通过降解靶点mRNAs:Gata2和Tal1来在转录后水平上施加调节活性,这一过程对于控制血细胞生成至关重要。
7.Nat Biotechnol:可注射的海绵状凝胶促进T细胞再生
doi:10.1038/s41587-019-0017-2
如今,在一项新的研究中,来自美国哈佛大学的研究人员开发出一种可注射的海绵状凝胶,可增强骨髓移植后的T细胞产生,从而增加了免疫系统中的这些关键组分的数量和多样性。这种生物工程支架(即海绵状凝胶)可在骨髓移植的同时注射到皮肤下,从而有助于在接受移植后恢复免疫系统。相关研究结果于2019年2月11日在线发表在Nature Biotechnology期刊上,论文标题为“An injectable bone marrow–like scaffold enhances T cell immunity after hematopoietic stem cell transplantation”。论文通讯作者为哈佛大学干细胞研究所联合主任David Scadden教授和哈佛大学工程与应用科学学院生物工程教授David Mooney。

图片来自Harvard University。
利用Mooney实验室在用于提供细胞指导性线索的生物材料开发方面的开拓性研究成果,这些研究人员设计了一种具有允许细胞进出的大孔的海绵状凝胶。这种凝胶具有两种内置的蛋白:第一种蛋白招募外部细胞,第二种蛋白促进T细胞祖细胞(T-cell progenitor)产生。第一种蛋白称为骨形态发生蛋白2(BMP2),招募局部的细胞并促进它们变成骨细胞。一旦这种凝胶类似于血管化的骨髓,第二种蛋白就促进生活在这种生物工程支架中的造血干细胞产生T细胞祖细胞。
当这些研究人员在接受造血干细胞移植的小鼠中测试这种生物工程支架时,他们发现相比于没有接受这种支架注射的小鼠,接受这种注射的小鼠更快地产生T细胞。
论文第一作者、哈佛大学工程与应用科学学院前博士后研究员Nisarg Shah说,“我们还发现我们不仅提高了在造血干细胞移植后这些T细胞形成的速度,而且还增加了所形成的T细胞类型的多样性。因此,我们不仅在改善T细胞的数量,而且还潜在地改善病原体识别和保护的广度。”
8.Cell Stem Cell:基因疗法可以用于治疗致命性自体免疫疾病
doi:10.1016/j.stem.2018.12.003
最近,加州大学洛杉矶分校研究人员创造了一种修复血液干细胞的基因突变的方法,以逆转导致威胁生命的自身免疫综合症(称为IPEX)的发生。这项工作在发表在最近的《Cell Stem Cell》杂志上。
IPEX是由一种突变引起的自身免疫疾病。该突变阻止了一种名为FoxP3的基因的表达,从而导致产生血液干细胞分化形成调节性T细胞的功能受到了阻碍。调节性T细胞可以负向控制身体的免疫系统的活性。缺少这一类细胞的话,免疫系统会攻击身体自身的组织和器官,最终导致自身免疫疾病的发生。
在这项新研究中,加州大学洛杉矶分校的研究人员使用病毒载体将FoxP3基因的正常拷贝传递到小鼠血液干细胞的基因组中,从而产生功能性调节性T细胞。在研究后不久,研究中的所有小鼠几乎没有IPEX症状。
9.PNAS:骨髓移植后干细胞是否会正常发挥功能?
doi:10.1073/pnas.1801480116
骨髓移植手术通过移植健康的血液干细胞,为许多类型的癌症,血液疾病和免疫疾病提供最佳治疗。在老鼠身上进行的一项新的研究表明:成功移植的干细胞并不会表现的像在供体体内一样。。相反,放射和高剂量化学疗法似乎会导致新移植的细胞产生“极端行为”。该研究结果于1月8日刊登在《PNAS》杂志上。

(图片来源:www.pixabay.com)
在一系列实验中,研究人员了解到,当移植到受辐射的小鼠中时,只有极少数干细胞会产生血液和免疫细胞,而许多其他干细胞则会变成休眠状态,什么都不做。此外,辐射后,这一小撮“活跃状态”的干细胞也变得偏向于仅产生某些类型的免疫细胞。然而,整体血液和免疫系统仍然趋于保持平衡。在没有经历辐射的小鼠中,除T细胞外,所有干细胞对血液和免疫系统的贡献相同,这表明用于确保成功移植的预处理(放疗,化疗)是细胞行为异常的原因。
10.Cell Stem Cell:震惊!高达10%的人体血细胞来自肠道中的造血干细胞库
doi:10.1016/j.stem.2018.11.007
科学家们之前曾认为血细胞是一群特殊的造血干细胞在骨骼中专门产生的。然而,在一项新的研究中,来自美国哥伦比亚大学瓦格洛斯内外科医生学会的研究人员吃惊地发现人体肠道可能利用它自身的造血干细胞库提供高达10%的用于人体循环的血细胞。相关研究结果于2018年10月29日在线发表在Cell Stem Cell期刊上,论文标题为“Human Intestinal Allografts Contain Functional Hematopoietic Stem and Progenitor Cells that Are Maintained by a Circulating Pool”。论文通讯作者为哥伦比亚大学的Megan Sykes。
当这些研究人员注意到接受肠道移植的患者的血液含有来自供者的血细胞时,他们发现了肠道中的造血干细胞库。他们追踪到这些供者血细胞的来源:供者肠道中的造血干细胞。
来自供者肠道的造血干细胞产生的血细胞也可能对移植受者有益。患者体内循环的供者血细胞越多,发生排斥肠道移植物的可能性就越小。
Sykes说,“携带着高水平供者细胞的患者可能不像当前这样需要那么多的免疫抑制药物,而且减少免疫抑制药物剂量可能改善治疗结果。”
11.Nature:中科院潘巍峻课题组揭示一类巨噬细胞引导造血干细胞归巢机制
doi:10.1038/s41586-018-0709-7
在一项新的研究中,中国科学院上海营养与健康研究院研究员潘巍峻(Weijun Pan)及其团队利用先进的实时成像和一种细胞标记系统,对斑马鱼尾部造血组织(相当于哺乳动物的胚胎肝脏)中的造血干细胞归巢进行高分辨率分析,并揭示出血管结构在调节造血干细胞归巢到壁龛微环境中的作用。相关研究结果于2018年11月19日在线发表在Nature期刊上,论文标题为“VCAM-1+ macrophages guide the homing of HSPCs to a vascular niche”。

图片来自Nature, doi:10.1038/s41586-018-0709-7。
潘巍峻团队鉴定出一种称为VCAM-1+巨噬细胞的壁龛细胞群体在静脉丛(venous plexus)的内表面上巡逻,以一种依赖于ITGA4的方式与造血干细胞相互作用,并指导造血干细胞归巢到壁龛微环境中。这些称为先导细胞(usher cell)的细胞与尾静脉毛细血管和静脉丛一起确定了造血干细胞在壁龛微环境中的归巢热点区域。
更重要的是,这些先导细胞在归巢热点区域附近巡逻,一旦发现造血干细胞来临时,就将它们引导到特定的血管结构中,从而实现造血干细胞归巢到壁龛微环境中。
总之,这项研究提供了关于造血干细胞归巢机制的新见解,并揭示出具有巡逻行为的VCAM-1 +巨噬细胞群体在造血干细胞归巢中发挥着重要的作用。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


