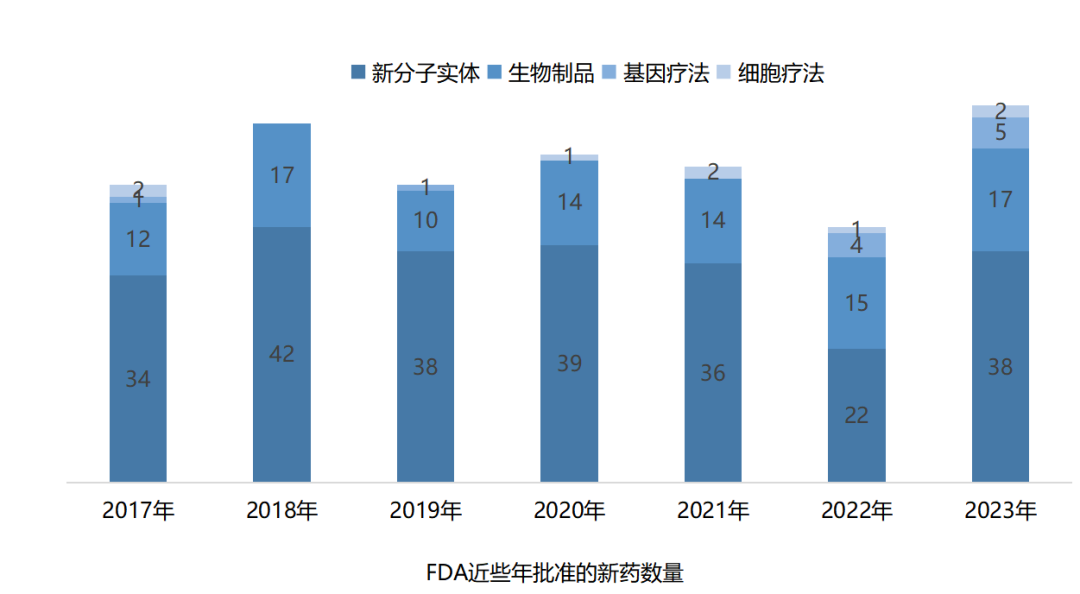
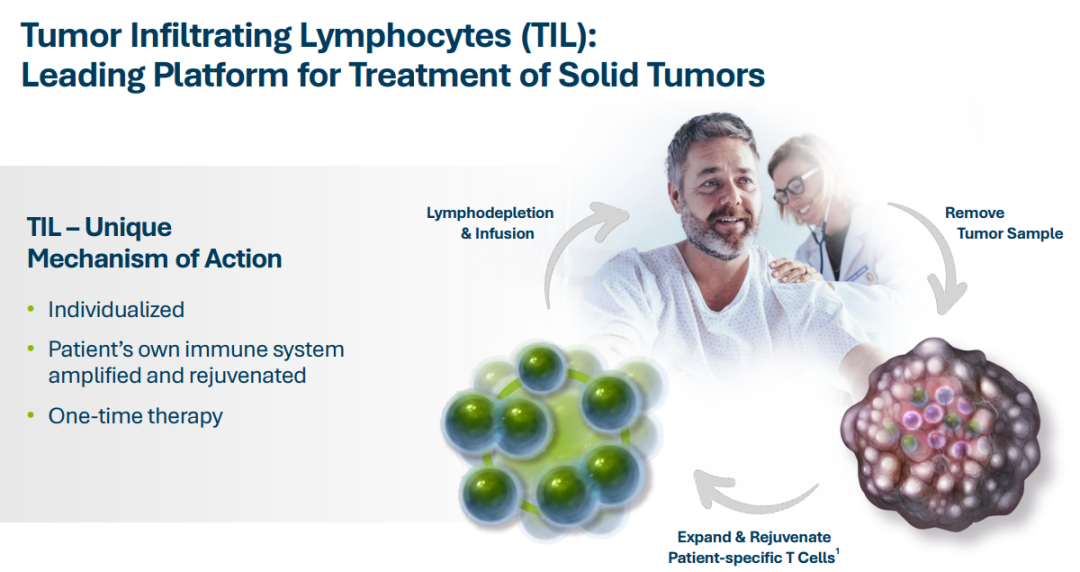
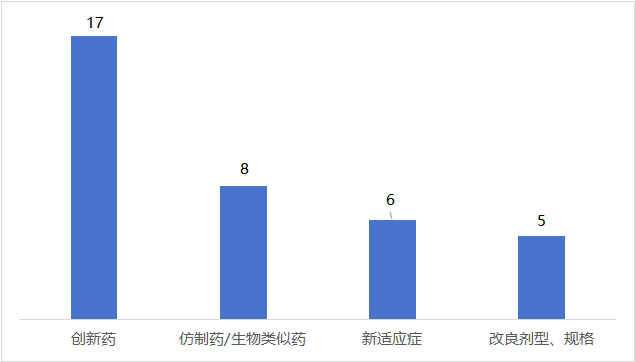
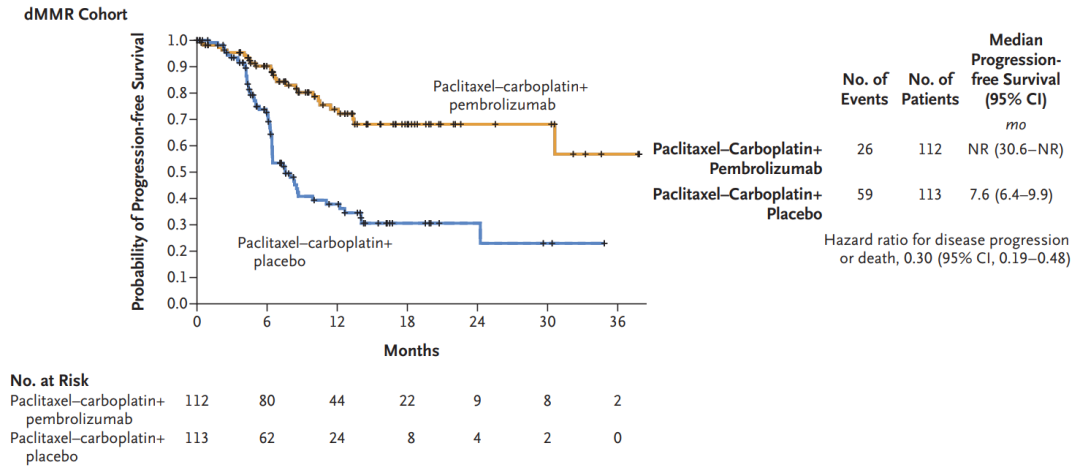
卫健委审批通过酶法甜菊糖苷丨甜菊糖苷·瑞鲍迪苷M研究报告发布
近日,国家卫生健康委发布公告,首次审批通过了利用酶转化法这一新工艺来制备富含瑞鲍迪苷M的甜菊糖苷,该工艺通过多种酶的高效催化再提纯可以将甜叶菊提取中的主要成分瑞鲍迪苷A高效生物转化为瑞鲍迪苷M。
2024-04-25
阿斯利康“first-in-class”口服小分子获FDA批准上市
中期疗效数据显示,第12周时与安慰剂加Ultomiris或Soliris相比,接受Voydeya加Ultomiris或Soliris患者的血红蛋白水平的最小二乘均值(LSM)相对于基线的变化显著增加。
2024-04-02
新型口服降压药获FDA批准上市
Aprocitentan是一款新型口服双重内皮素A/B受体(ETA/ETB)拮抗剂,可有效抑制ET-1与ETA和ETB的结合,它是马昔腾坦的活性代谢产物,具有更长的半衰期(48h vs. 14h)。
2024-03-22
FDA反馈积极:基于mRNA的细胞再生疗法,逆转皮肤衰老和脱发
Turn Biotechnologies 的一款细胞再生疗法(TRN-001)在美国FDA生物制品评价和研究中心的产品监管建议(INTERACT)会议上获得积极反馈,该会议旨在其皮肤细胞再生治疗的进展
2023-11-01
药物牧场DF-003获得美国FDA儿科罕见病资格认定(RPDD),用于治疗ROSAH综合征
致力于源头创新药物研发的生物医药公司药物牧场(Drug Farm)日前宣布,美国食品药品监督管理局(FDA)授予该公司ALPK1抑制剂First-in-class 新药DF-003
2024-01-16