2023年FDA批准的新药
来源:医药魔方 2024-01-03 11:08
2023年,美国FDA药品评价与研究中心(CDER)共批准了55款新药,包括38款新分子实体和17款生物制品。
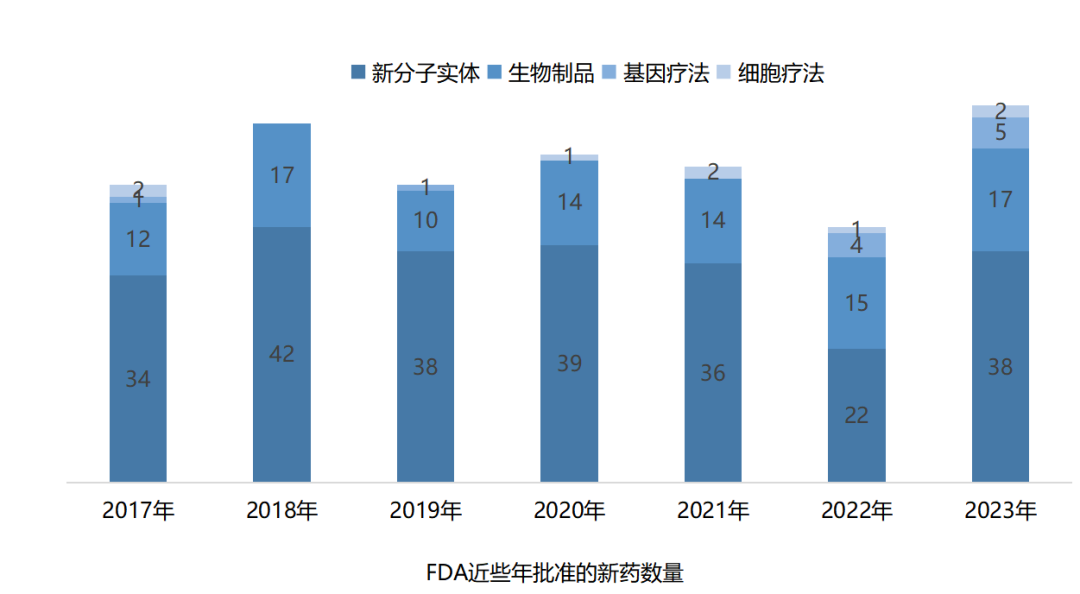
FDA生物制品评价和研究中心(CBER)共批准了16款新产品,包括5款基因疗法、2款细胞疗法、5款疫苗、1款微生物组疗法以及另外3款血液制品。
总体而言,2023年FDA批准的新药数量较往年有明显上涨,同时创新含量也在稳步攀升,CDER、CBER批准新药中分别有16款、9款“first-in-class”。在这些FIC药物中,药物类型丰富多样,其中小分子仍然是创新主力,以40%占比遥遥领先,而细胞基因疗法、小核酸药物等新型疗法也渐入佳境,接连成功闯关FDA,广泛受到市场认可。
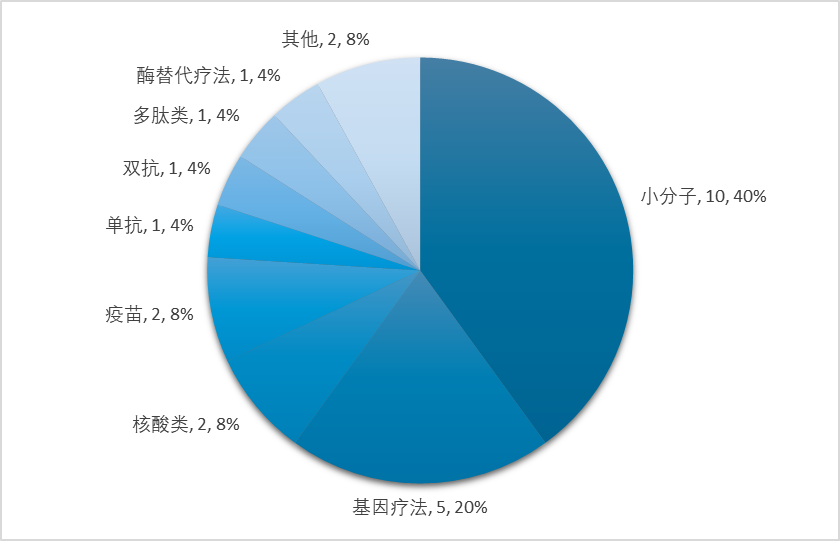
FIC药物类型分布
当然,无论药物类型多么炫目,最终目标还是解决临床上未满足的需求。从疾病领域来看,CDER批准新药多集中在肿瘤领域(25%)和罕见病(24%),其次为免疫炎症、感染、神经系统、心血管及代谢类疾病。
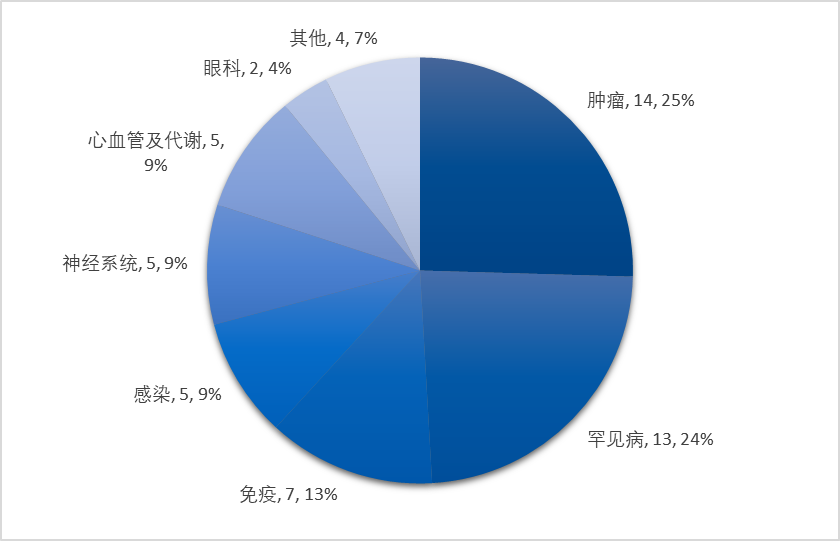
CDER批准新药疾病领域分布
值得一提的是,2023年是罕见疾病收获颇丰的一年,诸多遗传性免疫缺陷性疾病患者迎来新的治疗选择;肿瘤、免疫、感染、神经系统等疾病领域也都有多款重磅产品问世。由于篇幅有限,以下罗列了其中10款做一简单回顾。
20年来首款FDA完全批准AD新药:Leqembi
适应症:阿尔茨海默症
1月6日,渤健/卫材的抗β淀粉样蛋白(Aβ)单抗Leqembi(lecanemab)获FDA加速批准上市,用于治疗阿尔茨海默症(AD)。7月6日,FDA同意将加速批准转为完全批准。这意味着lecanemab成为了20年来首款获得FDA完全批准的AD新疗法。
Lecanemab能够选择性结合以中和消除可溶性、有毒的Aβ聚集体(原纤维),而这些聚集体被认为有助于AD中的神经退行性过程。III期关键研究显示,lecanemab不仅能降低淀粉样蛋白斑块,患者临床痴呆症状也可显著得到改善。
适应症:套细胞淋巴瘤
1月27日,礼来的Jaypirca(pirtobrutinib, 100mg和50mg片剂)获FDA加速批准上市,用于既往接受过至少二线系统治疗的复发或难治性套细胞淋巴瘤(MCL)成人患者,包括布鲁顿酪氨酸激酶(BTK)抑制剂,这是FDA批准的首个也是唯一一款非共价(可逆)BTK抑制剂。
Jaypirca既能抑制野生型也能抑制C481S突变型BTK,可以在既往使用共价BTK抑制剂(包括伊布替尼、阿卡替尼或泽布替尼)治疗的MCL患者中重建BTK抑制,并延长靶向BTK途径的益处。
首款治疗FA的药物:Skyclarys
适应症:弗立特里希氏共济失调
2月28日,FDA批准Reata Pharmaceuticals的Skyclarys(omaveloxolone)上市,用于治疗16岁及以上青少年和成年人弗里德赖希共济失调症(Friedreich’s Ataxia,FA)。这是美国首个也是唯一获批治疗FA的药物。今年7月底,渤健以每股172.5美元的价格现金收购Reata,交易总额约为73亿美元。
Omaveloxolone是一款每日口服一次的Nrf2激动剂。Nrf2是一种转录因子,通过恢复线粒体功能、减少氧化应激和抑制促炎信号来促进炎症消退。
适应症:肌萎缩侧索硬化
4月25日,渤健/Ionis联合推出的反义寡核苷酸疗法Qalsody(tofersen)获FDA加速批准上市,用于治疗超氧化物歧化酶1(SOD1)突变所致的肌萎缩侧索硬化(ALS)患者。这是首款针对ALS的基因靶向疗法。
Tofersen是一种用于治疗SOD1-ALS的反义寡核苷酸药物,可与编码SOD1的mRNA结合,使其被核糖核酸酶降解,从而减少SOD1蛋白的产生。
全球首款口服粪便微生物疗法:Vowst
适应症:预防复发性艰难梭菌感染
4月26日,Seres Therapeutics的口服微生物菌群疗法Vowst(SER-109)获FDA批准上市,用于预防复发性艰难梭菌感染(rCDI)。这是FDA批准的首款口服粪便微生物疗法。
SER-109是一种基于细菌孢子的口服微生物菌群疗法,从健康人粪便纯化而来,平均含有大约50种细菌,通过重建肠道菌群,抑制艰难梭菌的生长。SER-109的纯化过程旨在去除不需要的微生物,从而降低病原体传播的风险。此前,FDA已授予SER-109突破性疗法认定和孤儿药称号。
全球首款RSV疫苗:Arexvy
适应症:预防60岁及以上人群RSV感染导致的下呼吸道疾病
5月3日,FDA批准GSK的呼吸道合胞病毒(RSV)疫苗Arexvy上市,用于预防60岁以上成人因RSV感染而造成的下呼吸道疾病。这是全球首款获批上市的RSV疫苗。
5月31日,辉瑞旗下用于老年群体的RSV疫苗Abrysvo也获得FDA批准上市。8月21日,Abrysvo适应症获FDA扩大至:通过孕妇主动免疫,预防出生至6个月大的婴儿患上RSV相关下呼吸道疾病。
首款A型血友病基因疗法:Roctavian
适应症:A型血友病
6月29日,BioMarin的基因疗法Roctavian获FDA批准上市,是FDA批准的首款A型血友病基因疗法。
Roctavian是一款使用AAV5病毒载体递送表达凝血因子VIII(FVIII)转基因的基因疗法。该疗法优势在于可能只需要一次治疗即可获得表达FVIII的基因,因此患者不再需要长期接受预防性凝血因子注射。
全球首款GPRC5D/CD3双抗:Talvey
适应症:多发性骨髓瘤
8月9日,FDA加速批准强生GPRC5D/CD3双抗Talvey(talquetamab)上市,用于治疗复发或难治性多发性骨髓瘤(MM)成人患者,这些患者先前至少接受过4种治疗,包括蛋白酶体抑制剂,免疫调节剂和CD38抗体。
Talquetamab是一款first-in-class现货型双特异性T细胞结合抗体,能同时靶向MM细胞上的GPRC5D和T细胞上的CD3,通过激活CD3阳性T细胞,诱导T细胞对GPRC5D阳性MM细胞进行杀伤。
首款口服单药PNH疗法:Fabhalta
适应症:阵发性睡眠性血红蛋白尿症
12月5日,FDA批准诺华的Fabhalta(iptacopan)上市,用于成人阵发性睡眠性血红蛋白尿症(PNH)患者的治疗。这是首个获FDA批准的口服单药治疗成人PNH的药物。
Iptacopan是诺华研发的first-in-class、靶向补体旁路途径B因子的口服抑制剂。该产品作用于C5末端通路的上游,同时控制血管内溶血和血管外溶血,弥补了抗C5抗体的不足,同时为患者提供了口服单药的选择。
首款CRISPR基因编辑:Casgevy
适应症:镰状细胞病
12月8日,Vertex与CRISPR联合开发的CRISPR/Cas9基因编辑疗法Casgevy获FDA批准上市,用于12岁及以上输血依赖性地中海贫血患者或伴有复发性血管闭塞危象的镰状细胞病患者,这些患者没有人类白细胞抗原匹配的造血干细胞供体。这是全球首款获批上市的CRISPR基因编辑药物。
就在同日,FDA还批准了蓝鸟生物的一款基因疗法Lyfgenia上市,同样用于12岁及以上伴有复发性血管闭塞危象的镰状细胞病患者的治疗。这是蓝鸟生物推出的第3款基因疗法,据悉该产品定价为310万美元,此前治疗肾上腺脑白质营养不良的eli-cel和治疗β-地中海贫血的beti-cel定价分别为300万美元和280万美元。
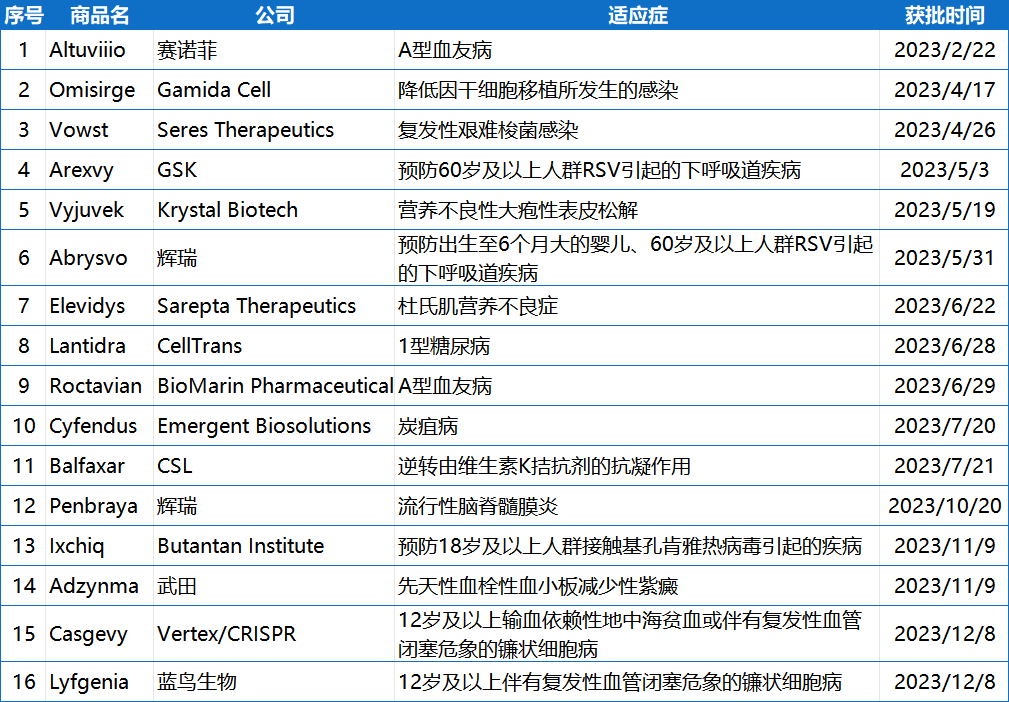
附表:2023年FDA批准的新药
2023年CDER批准新药

2023年CBER批准新药
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


