2021年终盘点:癌症疫苗重要研究进展解读!
来源:本站原创 2021-01-02 17:43
时至岁末,转眼间2021年已经接近尾声,迎接我们的将是崭新的2022年,在即将过去的2021年里,科学家们在癌症疫苗研究领域获得了多项重要研究成果,本文中,小编就对本年度科学家们在该研究领域取得的重磅级研究成果进行整理,分享给大家!
时至岁末,转眼间2021年已经接近尾声,迎接我们的将是崭新的2022年,在即将过去的2021年里,科学家们在癌症疫苗研究领域获得了多项重要研究成果,本文中,小编就对本年度科学家们在该研究领域取得的重磅级研究成果进行整理,分享给大家!
图片来源:Cell, 2021, doi:10.1016/j.cell.2021.11.007。
【1】Cell:揭示不同免疫细胞之间的交谈,有望开发出新型癌症疫苗
doi:10.1016/j.cell.2021.11.007
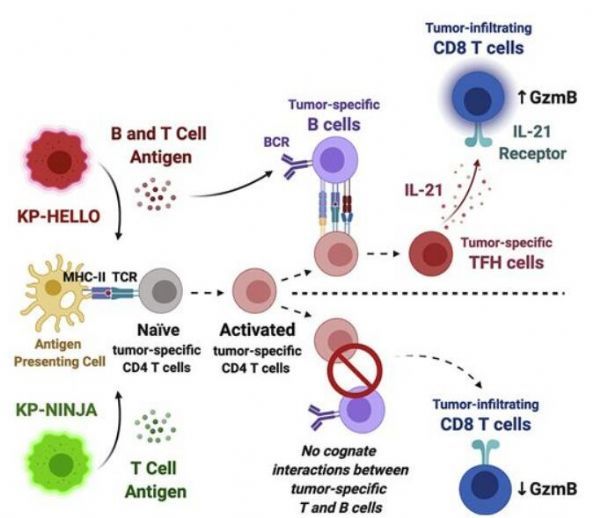
免疫疗法旨在加强免疫系统反应所遭遇的自然限制。在过去的十年中,这种方法已经帮助挽救了许多癌症患者的生命,其中许多是肺癌患者,否则他们几乎肯定会因患癌症而死亡。然而,在接受免疫疗法的患者中,只有约20%的人从这种治疗中看到了持续的好处。
如今,在一项新的研究中,来自美国耶鲁大学的研究人员帮助确定了免疫系统中不同类型的免疫细胞聚集在一起并相互交流以识别和消灭肿瘤的关键方式,这一见解可能帮助改善免疫疗法的临床疗效。这些发现可能为开发新型癌症疫苗铺平道路,可能有助于提高几种癌症中的患者生存率。相关研究结果发表在2021年12月9日的Cell期刊上。
近年来,科学家们已发现最有可能在肺癌中存活下来的患者往往在肿瘤周围形成类似淋巴结的结构。像淋巴结一样,这些结构产生了大量的免疫细胞,比如识别肿瘤的CD4辅助性T细胞;产生抗癌抗体的B细胞;以及能攻击癌细胞的CD8杀伤性T细胞。研究者Nikhil Joshi问道,“这个领域一直试图弄清楚这些免疫细胞是如何在肿瘤微环境中建立的,为什么它们与良好的治疗结果相关?”事实证明,这些免疫细胞是相互沟通的。在这项新的研究中,这些作者分析了癌症幸存者的肿瘤遗传学特性,然后构建出具有与这些幸存者相似遗传特征的小鼠模型。
【2】Nature子刊:利用二氧化硅覆盖癌细胞成功制造出新型癌症疫苗 或能激发机体抵御肿瘤发生的免疫反应
doi:10.1038/s41551-021-00795-w
利用自体肿瘤细胞所制成的个体化癌症疫苗或能因增强机体免疫原性的机制而获益;近日,一篇发表在国际杂志Nature Biomedical Engineering上题为“Cancer vaccines from cryogenically silicified tumour cells functionalized with pathogen-associated molecular patterns”的研究报告中,来自新墨西哥大学健康科学中心等机构的科学家们成功通过给癌细胞上包裹一层二氧化硅(silica)并将其注射到受试小鼠机体中,从而制造出了一种新型癌症疫苗;文章中,研究人员描述了他们制造这种个体化癌症疫苗的过程以及测试结果如何。
针对任何或所有形式的癌症疫苗都是医学科学家们不但研究的主要目标,目前科学家们在该领域已经取得了一些进展,比如开发了能有效抵御HPV的疫苗,该疫苗或能帮助女性有效预防因感染HPV病毒所导致的宫颈癌的发生,但在制造出直接抵御癌变肿瘤的疫苗之前,研究人员或许还有很多工作需要去完成,要么预防癌症的形成,要么在其形成之前就对其有效消除;大部分此类研究都基于一种刺激机体免疫系统的想法,从而就能使其更加积极地应对癌细胞。
很不幸的是,正如这篇文章中研究人员所指出的,机体并不会表达通用性的肿瘤抗原来用作开发有效的疫苗;这篇研究报告中,研究人员基于此前的研究结果开展最新的研究,即自体肿瘤细胞(收集自相同患者机体的细胞)或能被用来开发针对特定癌症类型的多克隆个体化疫苗,这或许就解决了科学家们必须找到一种普遍表达的肿瘤抗原的问题。
为此,研究人员一直在尝试使用一种新方法,即利用二氧化硅来覆盖自体肿瘤细胞,更确切地说,对肿瘤细胞进行低温硅化处理,这一过程包括使用一层非常微小的二氧化硅层来覆盖从患者机体中提取出的肿瘤抗原,这种方法能以一种使得抗原在后期照常能被使用的方法来保存肿瘤抗原,随后研究人员添加了一种病原体模拟涂层,最后的涂层能有效激活树突状细胞来刺激抗原进入T细胞。
【3】Nat Med:重磅!科学家开启首个预防人类三阴性乳腺癌发生的α-乳清蛋白疫苗临床试验!
doi:10.1038/nm.2161
尽管接种疫苗是有效预防疾病的最佳手段,但癌症疫苗的开发主要集中在对已经形成的肿瘤提供治疗上的帮助,开发预防性癌症疫苗的困难在于肿瘤的抗原是自身蛋白的突变体,如果能在预防性疫苗中被使用,其可能就会介导比较深远的自身免疫并发症的出现。近日,一篇发表在国际杂志Nature Medicine上题为“An autoimmune-mediated strategy for prophylactic breast cancer vaccination”的研究报告中,来自克利夫兰诊所等机构的科学家们进行了一项新型疫苗研究,旨在最终预防人类的三阴性乳腺癌,其是一种最具侵袭性且致死性的乳腺癌类型。
研究者进行的I期临床试验能帮助确定早期阶段三阴性乳腺癌患者对该疫苗的最大耐受剂量,并能确定和优化机体的免疫反应;FDA最近批准了该疫苗的新药申请,这或许就使得本文的研究人员能通过联合研究开始继续进行下一步的研究工作。医学博士G. Thomas Budd说道,我们希望这项研究能帮助后期进行更多先进的试验,从而确定疫苗对三阴性乳腺癌预防的效力;从长远来看,研究者希望他们所开发的疫苗能成为一种真正的预防性疫苗并能给健康女性注射从而帮助预防三阴性乳腺癌的发生。
目前研究人员非常需要开发出三阴性乳腺癌的改进型疗法,这类乳腺癌并不具有通常对激素或靶向性疗法能产生反应的生物学特征。尽管在所有乳腺癌中仅占到了大约12%-15%的比例,但其在乳腺癌死亡人数中所占的比例较高,而且癌症的复发率也相对较高;这类乳腺癌在非洲裔美国女性的机体中的发生风险是原来的两倍,而在携带BRCA1基因突变的女性机体中,大约70%-80%的乳腺肿瘤都是三阴性乳腺癌。

科学家识别出开发癌症疫苗的新靶点。
图片来源:Megan L.Burger,et al. Cell (2021). DOI:10.1016/j.cell.2021.08.020
doi:10.1016/j.cell.2021.08.020
抵御不同肿瘤新抗原的CD8 T细胞反应通常会同时发生,然而科学家们对反应之间的相互作用以及其对T细胞功能和肿瘤控制的影响却知之甚少。在过去10年里,科学家们一直在探索将疫苗接种作为一种抵御癌症的方式,这些实验性的癌症疫苗往往被设计成为能通过注射在肿瘤上发现的癌症蛋白片段,从而刺激机体自身的免疫系统来摧毁肿瘤。
截至目前为止,这些疫苗都没有得到FDA的批准,但有些疫苗在临床试验中展现出了极大的潜力来治疗黑色素瘤和某些肺癌;近日,一篇发表在国际杂志Cell上题为“Antigen dominance hierarchies shape TCF1+ progenitor CD8 T cell phenotypes in tumors”的研究报告中,来自麻省理工学院等机构的科学家们通过研究发现,针对特定癌症蛋白的疫苗或能增强机体整体的T细胞反应,同时还能缩小小鼠机体的肿瘤组织,这项研究发现或能帮助研究人员决定在癌症疫苗开发过程中纳入哪些蛋白质。
研究人员发现,针对他们所识别的蛋白类型来接种疫苗就能帮助机体重新唤醒针对这些蛋白质的休眠T细胞群,从而增强机体整体的免疫反应。研究者Tyler Jacks博士表示,本文研究强调了深入探索针对癌症的免疫反应的细节信息的重要性,如今我们发现,并非所有的抗癌免疫反应都是一样的,而且接种疫苗就能释放出针对一个靶点的强大反应,否则就会被有效地忽略掉。当细胞开始癌变时,其就会产生在健康细胞中并不存在的突变蛋白,这些称之为新抗原(neoantigens)的癌变蛋白就能提醒机体的免疫系统哪个环节出了问题,识别这些新抗原的T细胞就会开始破坏癌变细胞。
【5】Nat Commun:癌症疫苗或能有效克服癌细胞对疗法的耐受性
doi:10.1038/s41467-021-22115-1
在研究人员进行的表达干扰素β(VSV-IFNβ)的溶瘤性水泡性口炎病毒的相关临床试验中,有多名患者最初取得了初步的反应,但随后其疾病又复发了。日前,一篇发表在国际杂志Nature Communications上题为“Oncolytic virotherapy induced CSDE1 neo-antigenesis restricts VSV replication but can be targeted by immunotherapy”的研究报告中,来自梅奥诊所等机构的科学家们通过研究发现,一种癌症疫苗或能作为有效的方法来预防癌症进化并对疗法产生耐受性。
文章中,研究人员在临床试验中调查了一种杀灭癌细胞的病毒,他们表示,正如在小鼠机体中观察到的那样,最开始一些患者对疗法产生了反应,但随后患者机体的肿瘤很快就会产生抗性。研究者表示,利用一种疫苗或许就能预测并利用促进肿瘤细胞对病毒疗法产生耐受性的特定突变,当这种疫苗在小鼠机体中测试时,其或许能诱发机体免疫系统来破坏对疗法耐受的肿瘤细胞。相关研究结果或许也适用于驱动药物耐受性的其它类型的疗法,比如诸如PARP抑制剂的靶向性药物等。
这篇研究报告中,研究人员通过研究首次表明,这种类型的疫苗或能用来克服癌症的进化和耐受性;众所周知,利用抗癌病毒处理肿瘤细胞或许就会发生突变并促进癌细胞进化从而逃脱病毒的攻击,并使病毒疗法变得不再有效;科学家们发现,肿瘤细胞在感染病毒后会发生一种可预测的突变;病毒疗法会在癌细胞中引发名为CDSE1的基因突变,该基因能通过减缓病毒的复制从而来保护癌细胞免受病毒的攻击。
doi:10.1126/scitranslmed.abc2816
手术是大多数实体瘤患者的首选治疗方案,但包括局部根治性切除在内,一些肿瘤病人在手术治疗后会发生复发和转移,给临床治疗带来挑战。肿瘤术后复发转移和机体抗肿瘤免疫状态密切相关。肿瘤疫苗利用肿瘤抗原诱导机体自身的免疫反应对肿瘤细胞进行特异性杀伤。由于机体的免疫反应具有系统性和全身性的特点,这种疗法不仅可以对术后残留的肿瘤病灶进行特异性杀伤,也能够有效作用于远端转移的细胞,相比于其他治疗方法作用,其范围更特异且广泛。然而,由于肿瘤抗原免疫原性较弱,如何将多样化、异质性的肿瘤抗原高效地呈递给机体免疫系统,这成为相关肿瘤疫苗设计的关键问题。虽然细菌来源的分子能够作为佐剂增强疫苗中抗原的免疫原性,也有不少商用佐剂利用细菌成分来激活机体固有免疫反应。然而,以脂多糖为代表的这类佐剂可能会过度激活非特异性的免疫反应,产生细胞因子风暴等严重副作用。因此,如何在保证良好安全性的前提下,发展新型佐剂或疫苗系统以实现更有效、更广谱的抗肿瘤效果,成为目前研究的关键问题。
近日,国家纳米科学中心研究员聂广军、吴雁研和中国科学院院士赵宇亮团队合作,在个性化纳米肿瘤疫苗设计研究中取得进展。相关研究成果以Bacterial cytoplasmic membranes synergistically enhance the antitumor activity of autologous cancer vaccines为题,在线发表于《科学-转化医学》(Science Translational Medicine)。针对临床中肿瘤术后易复发转移和相关肿瘤疫苗设计的难点,研究人员根据肿瘤细胞和细菌的细胞结构,巧妙地利用纳米技术,将含有肿瘤抗原信息的肿瘤细胞膜和含有佐剂信息的细菌内膜展示于聚合物纳米颗粒表面,制备成个性化的杂合膜纳米肿瘤疫苗。
这种疫苗中的细菌膜成分能够向机体免疫系统提供外源的“危险信号”,使源于患者“自体”的肿瘤膜能够一起被认为是危险入侵者进而高效地被树突状细胞摄取,从而提高肿瘤抗原的递送和呈递效率。由于疫苗中的佐剂成分使用的是不含有细菌脂多糖的细菌内膜,不易引起细胞因子风暴等免疫治疗相关的副作用。实验结果表明,杂合膜疫苗能够激发强烈的特异性抗肿瘤免疫反应,在多种小鼠肿瘤模型中都可有效抑制肿瘤复发,延长其术后生存期。此外,该疫苗也能够有效诱导记忆T细胞的产生,防止肿瘤再次侵袭。总之,研究团队构建的个性化纳米疫苗能够实现个性化肿瘤膜抗原的有效递送,诱导机体产生特异性免疫反应抑制肿瘤的术后复发,具备在多种实体瘤中应用的潜力,具有广阔的临床应用前景。
【7】Nature子刊:新型癌症疫苗让免疫检查点抑制剂更有效
doi:10.1038/s41467-021-23244-3
在过去的10多年中,免疫检查点抑制剂为癌症治疗带来了巨大的改变,但是这类疗法的有效性仍然有限,大多数接受免疫检查点抑制剂治疗的患者没有获得完全缓解,仅有20%的实体瘤患者在治疗后肿瘤完全缓解。这可能与免疫检查点抑制剂的作用特点有关,免疫检查点抑制剂通过延长机体免疫应答发挥作用,这种作用依赖于机体免疫细胞,如果人体无法将肿瘤细胞识别为异物,那么免疫检查点抑制剂也就无法使免疫细胞发挥作用。
为了提高肿瘤对免疫检查点抑制剂的应答,来自德国康斯坦茨大学的一个研究小组开发了一种癌症疫苗,临床前肿瘤模型的数据显示这种癌症疫苗能延缓原发性肿瘤的生长,防止转移,并能延长小鼠的生存期,而且将疫苗与免疫检查点抑制剂联合使用,可以大大提高对治疗有应答的个体比例,75%的小鼠肿瘤完全缓解。研究结果发表在Nature Communications上。
研究团队将抗原与免疫佐剂Riboxxim一起封装在聚乳酸-乙醇酸共聚物(PLGA)颗粒中制成研究所用的癌症疫苗。Riboxxim是一种双链(ds)RNA佐剂,通常通过触发TLR3(toll样受体3)发挥作用,在与TLR配体共递送后,这一疫苗可有效激活鼠和人DC细胞,增强抗原呈递,并能提高肿瘤特异性CD8 T细胞的应答。
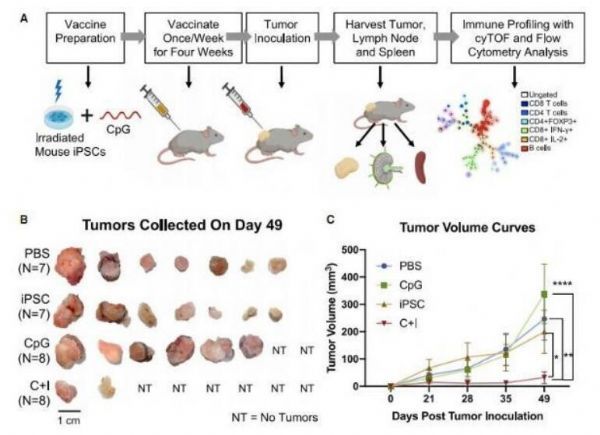
小鼠的iPSC疫苗或能在体内抑制肿瘤形成。
图片来源:Xiaoming Ouyang,et al. Stem Cell Reports (2021). doi:10.1016/j.stemcr.2021.04.004
【8】Stem Cell Rep:基于诱导多能干细胞的疫苗策略或有望产生强大的抗胰腺癌潜能
doi:10.1016/j.stemcr.2021.04.004
胰腺导管腺癌(PDAC)是美国癌症相关死亡的第四大原因,在过去几十年里PDAC患者的5年生存率一直处于个位数的水平;截止到目前为止,手术依然是治疗这种疾病最有效的方法;然而,仅有大约10%的患者能够在早期阶段被诊断出来,从而及时接受手术来移除肿瘤。尽管科学家们在免疫检查点抑制剂研究领域取得了一定的成功,但PDAC仍然对这些药物制剂具有一定的耐受性,这就使得这类癌症因其间质促纤维增生、缺乏效应T细胞及较低的突变负担而成为了一种难治性的癌症。
诱导多能干细胞(ipsCs)和癌症拥有细胞的相似性和转录组特性;日前,一篇发表在国际杂志Stem Cell Reports上题为“Antitumor effects of ipsC-based cancer vaccine in pancreatic cancer”的研究报告中,来自斯坦福大学等机构的科学家们通过研究深入探究了使用诱导多能干细胞中的非突变肿瘤相关蛋白质来作为开发PDAC疫苗基础的可能性。我们都知道,适应性免疫系统能够识别并对非突变肿瘤相关的抗原(TAAs)产生反应,FDA批准的名为Provenge的治疗性癌症疫苗就能作为一种基于TAA的疫苗;研究人员指出,诱导多能干细胞和癌细胞共享着基因表达谱,对iPSC细胞系和癌细胞系的RNA测序数据进行聚类分析后,研究者发现其二者共享着上调基因,这种被称为ipsC-癌症特征性基因的特殊基因能被多潜能细胞群高度表达,但在体细胞组织中仅会轻微或根本不表达。
研究者表示,基于iPSC的癌症疫苗能诱导小鼠机体出现iPSC特异性的抗肿瘤T细胞反应,而iPSCs和癌细胞之间的共享蛋白则包含能诱导抗肿瘤免疫力的非突变TAAs,然而,研究人员并不清楚是否基于ipsC的癌症疫苗能诱导肿瘤 中出现有效的抗肿瘤免疫力,比如携带较低突变负担的PDAC。这篇研究报告中,研究人员开发了一种新型策略来训练小鼠机体的免疫系统从而识别癌细胞,该研究基于科学家们的近期研究成果,即诱导多能干细胞能产生一大类与特定类型胰腺癌有重叠的抗原,而这些相似之处或许能产生潜在的临床效益。
【9】Nature:首例脑癌患者接种突变蛋白疫苗显示安全有效!
doi:10.1038/s41586-021-03363-z
手术切除是临床上肿瘤治疗的主要手段之一,而残留的微小肿瘤组织或循环肿瘤细胞会导致肿瘤复发或转移,也是肿瘤治疗面临的重大挑战。肿瘤疫苗可以通过激活持续的抗肿瘤免疫保护效应,抑制肿瘤复发和转移,在肿瘤术后治疗方面有巨大潜力。来自海德堡和曼海姆的医生和癌症研究人员首次开展了一项临床试验,测试一种针对恶性脑肿瘤的突变特异性疫苗。该研究发布在Nature杂志上,研究结果表明:疫苗是安全的,并在肿瘤组织中触发了所需的免疫反应。
弥漫性神经胶质瘤通常是无法治愈的脑部肿瘤,会扩散到整个脑部,很难通过手术彻底清除,化疗和放疗往往效果有限。在很多情况下,弥漫性胶质瘤具有一个共同特征:在70%以上的患者中,肿瘤细胞具有相同的基因突变。DNA中相同的错误导致在IDH1(异柠檬酸脱氢酶1)酶中单一、特定的蛋白质构建块被交换。这就产生了一种新的蛋白质结构,即所谓的新表位,它可以被患者的免疫系统识别为异物。
研究者表示,“我们的想法是支持患者的免疫系统,并使用疫苗作为一种有针对性的方式来提醒它注意肿瘤特异性新表位。IDH1突变是一个特别合适的候选者,因为它对胶质瘤具有高度特异性,并且不会发生在健康组织中。此外,IDH1突变是这些胶质瘤发展的原因,这意味着针对突变蛋白的疫苗可以从根本上解决问题。”
【10】Nat Med:1期临床试验表明接种癌症疫苗4年后,黑色素瘤患者产生持久的抗肿瘤反应
doi:10.1038/s41591-020-01206-4
在一项新的研究中,来自美国丹娜-法伯癌症研究所、布莱根妇女医院和布罗德研究所的研究人员报道,在黑色素瘤患者接受个性化癌症疫苗治疗4年后,这种疫苗引发的免疫反应仍然强大,并能有效地控制癌细胞。相关研究结果于2021年1月21日在线发表在Nature Medicine期刊上。
这些研究结果展示了这种称为NeoVax的疫苗产生的免疫反应的持久力,它通过靶向每个患者肿瘤细胞上的特定蛋白发挥作用。这些研究人员发现,在接种这种疫苗近四年后,患者的免疫系统细胞不仅活跃地抵抗表达这些独特蛋白的肿瘤细胞,而且还会靶向这些患者的肿瘤细胞中发现的其他蛋白。
论文共同作者Catherine J. Wu博士说,“这些研究结果表明个性化新抗原疫苗可以在黑色素瘤患者中刺激持久的免疫反应。我们发现的证据表明,最初的有针对性的免疫反应在过去的几年里已经扩大,为患者提供持续的保护,使其免受这种疾病的影响。”
该研究涉及8名患者,他们因患上晚期黑色素瘤而接受外科手术,但被认为有复发的高风险。在一项1期临床试验中,他们在手术后的中位数18周内接受了NeoVax治疗。这种疫苗由称为表位(epitope)的蛋白片段制成,这些表位从细胞表面延伸出来,作为免疫系统的信号起作用。NeoVax中的表位来自于新抗原(neoantigen),即肿瘤细胞上的异常蛋白,可提醒细胞发生癌变,应该被摧毁。鉴于新抗原只存在于肿瘤细胞上,它们会引发使正常细胞免受攻击的免疫反应。
(生物谷Bioon.com)
生物谷2021年终盘点正在进行!更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。