Nature重磅:首例脑癌患者接种突变蛋白疫苗显示安全、有效
来源:生物谷 2021-03-26 11:49
手术切除是临床上肿瘤治疗的主要手段之一,而残留的微小肿瘤组织或循环肿瘤细胞会导致肿瘤复发或转移,也是肿瘤治疗面临的重大挑战。肿瘤疫苗可以通过激活持续的抗肿瘤免疫保护效应,抑制肿瘤复发和转移,在肿瘤术后治疗方面有巨大潜力。来自海德堡和曼海姆的医生和癌症研究人员首次开展了一项临床试验,测试一种针对恶性脑肿瘤的突变特异性疫苗。该研究发布在《自然》杂志上,研究结果表
手术切除是临床上肿瘤治疗的主要手段之一,而残留的微小肿瘤组织或循环肿瘤细胞会导致肿瘤复发或转移,也是肿瘤治疗面临的重大挑战。肿瘤疫苗可以通过激活持续的抗肿瘤免疫保护效应,抑制肿瘤复发和转移,在肿瘤术后治疗方面有巨大潜力。
来自海德堡和曼海姆的医生和癌症研究人员首次开展了一项临床试验,测试一种针对恶性脑肿瘤的突变特异性疫苗。该研究发布在《自然》杂志上,研究结果表明:疫苗是安全的,并在肿瘤组织中触发了所需的免疫反应。
弥漫性神经胶质瘤通常是无法治愈的脑部肿瘤,会扩散到整个脑部,很难通过手术彻底清除,化疗和放疗往往效果有限。在很多情况下,弥漫性胶质瘤具有一个共同特征:在70%以上的患者中,肿瘤细胞具有相同的基因突变。DNA中相同的错误导致在IDH1(异柠檬酸脱氢酶1)酶中单一、特定的蛋白质构建块被交换。这就产生了一种新的蛋白质结构,即所谓的新表位,它可以被患者的免疫系统识别为异物。
研究者表示,“我们的想法是支持患者的免疫系统,并使用疫苗作为一种有针对性的方式来提醒它注意肿瘤特异性新表位。IDH1突变是一个特别合适的候选者,因为它对胶质瘤具有高度特异性,并且不会发生在健康组织中。此外,IDH1突变是这些胶质瘤发展的原因,这意味着针对突变蛋白的疫苗可以从根本上解决问题。”
该研究纳入了33名患者,1名患者(ID16)因接种前发生不良事件(原因不明的发热)而未接种疫苗。因此,32名患者接受了治疗,被纳入安全性数据集(SDS)。20名患者(62.5%)为男性,12名(37.5%)为女性,平均年龄为40.4±8.95岁。
根据患者入组前接受的标准护理(SOC)治疗,将试验对象分为三个治疗组(TG1-TG3):单纯放疗(RT,TG1)、单纯TMZ三周期化疗(单TMZ,TG2)或TMZ联合放化疗(RT+cTMZ,TG3)。大多数患者在接种IDH1疫苗前同时接受了放化疗和TMZ(n = 23,71.9%);3名(9.4%)单独接受TMZ治疗,6名(18.8%)单独接受放疗。在32名患者中,有21名(65.6%)患有世界卫生组织(WHO)的3级星形细胞瘤,而11名(34.4%)患有4级星形细胞瘤。
基线和SOC治疗时的患者特征
SDS中32名患者中的30名(93.8%)和免疫原性数据集(IDS;93.3%)中30名患者中的28名达到了治疗结束(EOT)。最大治疗时间为23周。SDS的中位随访时间(截至2020年6月)为46.9个月(95%置信区间(CI):45.2-49.2个月),IDS为47.1(45.2-49.2)个月。
SDS组32例患者中有29例(90.6%)和IDS组30例患者中有27例(90.0%)接种了8次疫苗;一名患者接种了7次,一名接种了6次,还有一名接种了4次。32例患者中有29例(90.6%)发生了治疗相关的不良事件,但不严重。1例患者(3.1%)发生了与治疗相关的严重不良事件,1例患者(3.1%)因治疗相关的不良事件而暂停使用。
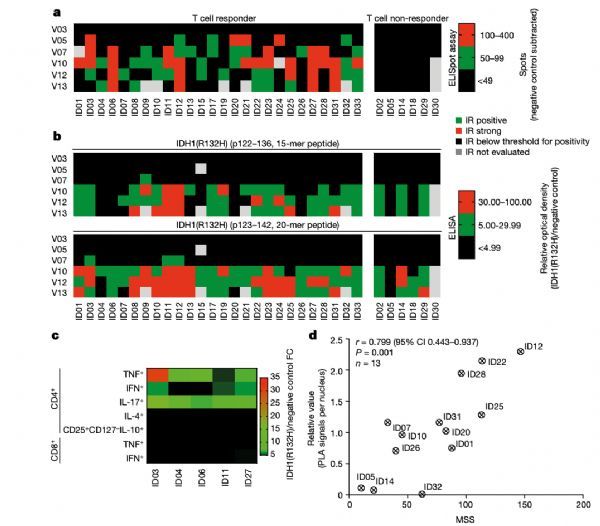
在IDS的30名患者中,28名(93.3%;95% CI 77.93-99.18%)显示出IDH1-vac诱导的免疫反应;26名患者观察到IDH1-vac诱导的T细胞免疫反应;28名患者观察到跨越多种人类白细胞抗原(HLA)等位基因的B细胞免疫反应。这些反应与IDH1(R132H)肽的体外HLA亲和力无关。两名患者(6.7%)既未出现T细胞也未出现B细胞免疫反应。
IDH1-vac的细胞和体液免疫原性
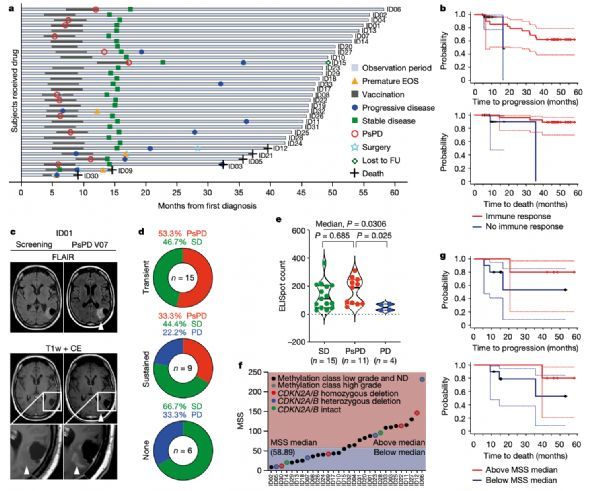
SDS的总体反应率为84.4%(95% CI 67.21-94.72%,32例患者中的27例),对应于研究结束时IDS的86.7%(95% CI 69.28-96.24%,30例患者中的26例)。在SDS的随访分析中,三年无进展率和无死亡率分别为0.63(95% CI 0.44-0.77)和0.84(95% CI 0.67-0.93)。两名没有引起IDH1-vac诱导的免疫应答的IDS患者(ID05和ID30),与有免疫应答的患者相比两年无进展率为0.82 (95% CI 0.623-0.921)。
在SDS中,32名患者中有12名(37.5%)发生假性进展(PsPD),而分子匹配的对照队列中60名患者中有10名(16.7%)发生假性进展。通过脑成像诊断出的对比增强型PsPD是腔内炎症反应的指标。与年龄、切除范围、SOC治疗或WHO等级无明显关联。匹配队列中较长的中位观察期(7.3年)导致偏向于检测更多的PsPD。
IDH1-vac的疗效、假性进展和T细胞反应
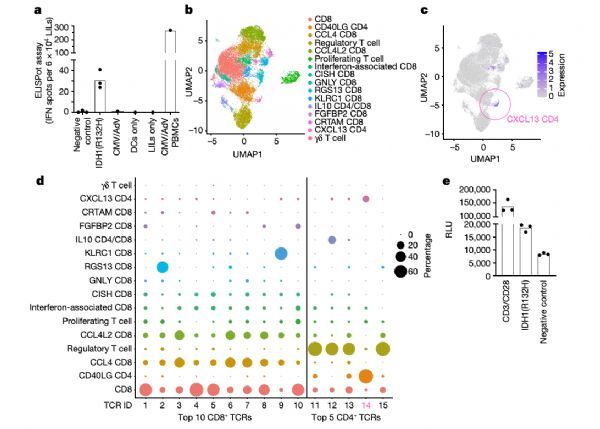
在PsPD患者中,只有ID08患者进行了病灶切除术。单细胞RNA测序(scRNA-seq)在ID08患者的PsPD病灶内发现了三个CD4+T细胞簇:调节性T细胞、活化的CD40LG+CD4+T细胞和CXCL13+CD4+T细胞。据报道,CXCL13+CD4+ T细胞对抗肿瘤免疫很重要。通过结合scRNA-seq和TCR测序,研究人员发现CD40LG+CD4+和CXCL13+CD4+T细胞群都是由一个TCR(TCR14)主导。
总的来说,TCR14是CD4+单T细胞序列内第四大丰富的TCR,而前三大丰富的CD4+TCR(TCR11-13)是在调节性T细胞上表达的,这些T细胞基本上缺乏TCR14。给予IDH1-vac后,与该患者外周血相比,ID08患者PsPD病灶中TCR14富集了50.6倍。在与ID08患者自体抗原呈递细胞共培养的TCR缺陷人T细胞系中转基因TCR表达显示,TCR14对IDH1(R132H)有反应。这些结果表明,IDH1-vac诱导IDH1(R132H)特异性TH细胞的克隆扩张,浸润到切除的病灶中。
IDH1-vac相关的PsPD的分子T细胞表型
总而言之,在接种过疫苗的患者中,未观察到任何严重的副作用。在93%的患者中,免疫系统对疫苗肽表现出特异性反应,无论患者的遗传背景如何,免疫系统的重要呈现分子--HLA蛋白都会产生特异性反应。
在很大比例的接种疫苗的患者中,医生观察到了假性进展,这是由大量入侵的免疫细胞引起的肿瘤肿胀。单细胞测序显示,这些患者的血液中有大量的辅助T细胞,其免疫受体对疫苗肽有特异性反应。研究人员表示,该研究结果还证明了激活的突变特异性免疫细胞已侵入脑肿瘤组织。
在完全接种疫苗的患者中,治疗后的三年生存率为84%,63%的患者在此期间肿瘤生长没有进展。在免疫系统对疫苗产生特异性反应的患者中,共有82%的患者在三年内没有肿瘤进展。
研究人员还准备进行II期研究,以检查IDH1疫苗是否比单独的标准治疗产生更好的治疗效果。(生物谷 bioon)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。