FDA已接受阿斯利康抗血小板疗法替格瑞洛的补充新药申请
阿斯利康(AstraZeneca)今天宣布,美国食品药品监督管理局(FDA)已接受其抗血小板疗法替格瑞洛(ticagrelor,英文商品名Brilinta)的补充新药申请(sNDA),并授予其优先审评资格,与阿司匹林联用,用于减少发生急性缺血性中风或短暂性脑缺血发作(TIA)患者的后续中风。预计这一申请将在今年第四季度获得回复。新闻稿指出,如果获得批准,替格
葛兰素史克欣安立适(Shingrix)在中国正式上市,用于≥50岁成人预防带状疱疹!
Shingrix是目前国内唯一已上市的重组带状疱疹疫苗,填补国内带状疱疹疾病预防空白,助力实现“健康中国2030”。
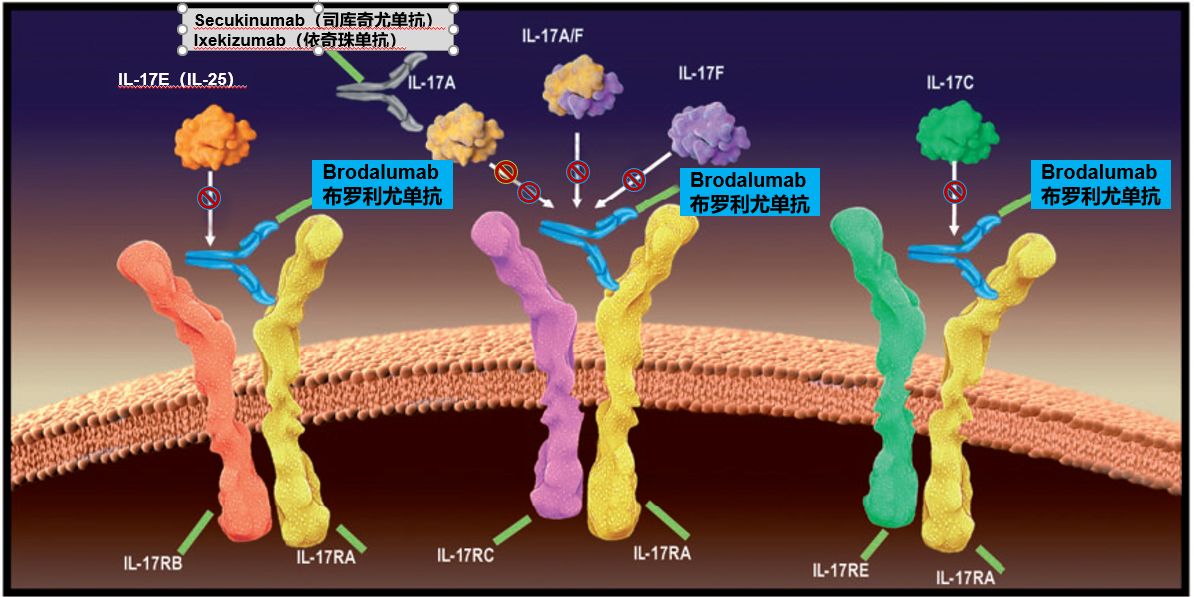
首个以白介素17受体A为靶点的银屑病生物制剂立美芙®(布罗利尤单抗)在华获批
协和发酵麒麟(中国)制药有限公司近日宣布,立美芙®(通用名:布罗利尤单抗)获得国家药品监督管理局批准,用于适合系统治疗或光疗的成人中至重度斑块状银屑病。此次加速审批,是由于2018年国家药品监督管理局药品审评中心把立美芙®纳入《第一批临床急需境外新药名单》。中华医学会皮肤性病学分会第13届主任委员,北京大学人民医院皮肤科主任张建中教授表示:布罗利
呋喹替尼获FDA快速通道资格 海外上市进程加速
近日,和黄医药旗下靶向抗癌药呋喹替尼获得了FDA授予的快速通道资格,用于治疗转移性结直肠癌(mCRC)患者。作为FDA建立的加速审评审批程序之一,快速通道资格的获取意味着药品在研发和注册过程将得到FDA更多的关注,缩短新药研发上市的时间。和黄医药呋喹替尼获得FDA授予的快速通道资格,无疑将加快该药在美国的上市进程,为海外的转移性结直肠癌患者带来新
百济神州在欧洲申报泽布替尼上市申请获受理
6月18日,百济神州宣布欧洲药品管理局(EMA)已确认受理百悦泽(泽布替尼)的上市许可申请(MAA),适用于既往接受过至少一项疗法的华氏巨球蛋白血症(WM)患者或作为不适合化学免疫疗法WM患者的一线治疗方案。目前,百悦泽在美国和中国以外国家地区尚未获批。华氏巨球蛋白血症(WM)是一类罕见淋巴瘤,约占所有非霍奇金淋巴瘤的1%,通常在确诊后进展缓慢。
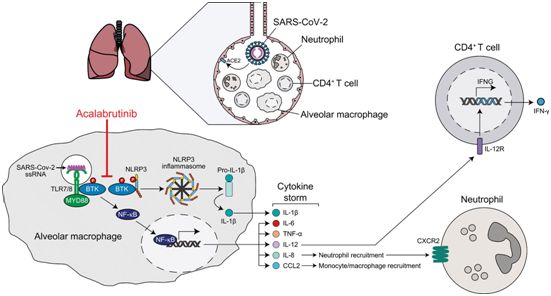
Science子刊:抗癌药物阿卡替尼有望治疗重症COVID-19患者中的细胞因子风暴
2020年6月15日讯/生物谷BIOON/---来自一项临床研究的早期数据表明,阻断布鲁顿酪氨酸激酶(Bruton tyrosine kinase, BTK)可为一小群重症COVID-19患者提供了临床益处。负责开展这项研究的研究人员观察到非标签使用抗癌药物阿卡替尼(acalabrutinib,也译为阿卡鲁替尼)与大多数接受治疗的患者呼吸困难减轻和过度活跃的
治疗艾滋病 正大天晴恩曲他滨替诺福韦片首仿获批!
6月9日,中国生物制药发布公告称,集团开发的治疗艾滋病药物恩曲他滨替诺福韦片(商品名:克艾可)已获得国家药监局颁发药品注册批件,为该品种仿制药国内首家获批,且视同通过一致性评价。恩曲他滨替诺福韦片用于治疗成人和12岁(含)以上儿童的HIV-1感染,原研药企为吉利德。米内网数据显示,2019年恩曲他滨替诺福韦全球销售额28亿美元。资料显示,恩曲他滨替诺福韦片含
美国FDA批准Tivicay PD(多替拉韦分散片),用于≥4周、≥3公斤儿科患者!
Tivicay PD是FDA批准的第一个分散片配方的整合酶抑制剂,将缩小成人和儿童HIV治疗方案的差距。
FDA为阿斯利康替格瑞洛开绿灯
阿斯利康宣布,Brilinta(替格瑞洛)已在美国获批用于降低高危冠心病(CAD)患者的首次心脏病发作或卒中风险,CAD是最常见的心脏病类型。这是监管机构首次批准阿司匹林联合替格瑞洛,双重抗血小板治疗心血管(CV)高风险但无心脏病发作或卒中病史的患者。该药最早于2011年7月20日获FDA批准用于急性冠状动脉综合征(ACS)患者,降低血栓性心血管