Science:合成IL-2回路促进CAR-T细胞浸润免疫抑制性的实体瘤
来源:生物谷原创 2022-12-30 10:52
在一项新的研究中,研究人员设计出携带合成细胞因子回路的治疗性T细胞,在其中,肿瘤特异性synNotch(synthetic Notch)受体驱动IL-2的产生。
许多实体瘤对T细胞疗法没有反应,因为它们的免疫抑制性微环境阻止了T细胞的浸润、激活和增殖。主要的肿瘤抑制机制包括抑制T细胞受体(TCR)的信号传导和消耗炎性细胞因子。克服抑制性肿瘤微环境仍然是实体瘤免疫疗法的一个主要障碍。
用炎性细胞因子---比如高剂量的IL-2---补充T细胞的活性,长期以来一直被认为可以驱动有效的抗肿瘤功能。然而,全身性IL-2治疗已被证明具有很强的毒性,会导致严重的不良反应,包括毛细血管渗漏综合征和最终的终末器官功能障碍。细胞自主的细胞因子产生有潜力通过在局部和直接向肿瘤递送细胞因子来克服这些毒性。在一项新的研究中,来自美国加州大学旧金山分校的研究人员设计出携带合成细胞因子回路的治疗性T细胞,在其中,肿瘤特异性synNotch(synthetic Notch)受体驱动IL-2的产生。这种靶向肿瘤的IL-2递送回路提供了一种潜在的方法,可以在局部克服肿瘤抑制,同时将全身性IL-2治疗的毒性降到最低。相关研究结果发表在2022年12月16日的Science期刊上,论文标题为“Synthetic cytokine circuits that drive T cells into immune-excluded tumors”。

这些作者察到他们设计的synNotch诱导IL-2产生的回路(下称synNotch→IL-2回路)促使嵌合抗原受体(CAR)或TCR T细胞有效地浸润到胰腺癌和黑色素瘤的免疫抑制性肿瘤模型中。在这些具有挑战性的免疫功能的肿瘤模型中,这种浸润的改善与肿瘤清除率和生存率的大幅提高有关。与全身递送IL-2不同,这种局部的IL-2回路不显示毒性,因为它不依赖于TCR/CAR的激活,但仍靶向肿瘤。
然而,用于递送IL-2的确切机制被证明是至关重要的。与经设计后IL-2组成性表达或TCR/CAR诱导的IL-2表达(如来自活化T细胞核因子(NFAT)启动子)的CAR-T细胞相比,携带synNotch→IL-2回路的CAR-T细胞具有更好的抗肿瘤效果。此外,这些作者发现,IL-2的自分泌产生,即同一T细胞表达CAR/TCR和synNotch→IL-2回路,被证明是至关重要的。IL-2的旁分泌递送,即CAR-T细胞受到携带synNotch→IL-2回路的独立T细胞支持,在存在竞争性的内源性IL-2消耗细胞(即消耗IL-2的细胞)---比如宿主调节性T细胞或旁观者T细胞---时,被证明是无效的。
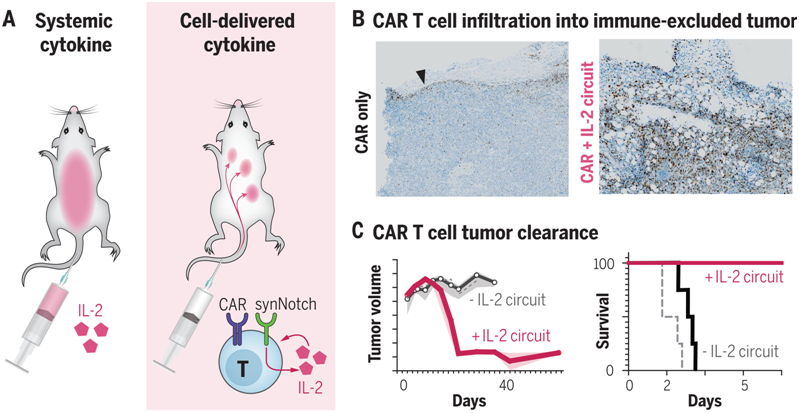
经过基因改造后的治疗性T细胞在肿瘤触发IL-2产生后浸润并清除免疫抑制性的肿瘤。图片来自Science, 2022, doi:10.1126/science.aba1624。
高维免疫分析显示这种IL-2合成细胞因子回路主要作用于T细胞群体,而不会对其他免疫细胞区室造成明显变化。CAR-T细胞和宿主旁观者T细胞对肿瘤的浸润都明显增加。然而,只有抗肿瘤的CAR-T细胞显示出增加的激活、增殖和细胞毒性标志物,以及下降的衰竭标志物。
这些作者猜测这种synNotch→IL-2回路是有效的,因为它绕过了对TCR/CAR激活的要求,并以更强有力的自分泌方式提供IL-2。因此,这些特征使得工程化T细胞能够克服肿瘤免疫抑制的主要模式:抑制TCR信号传递和竞争性细胞因子消耗。这些工程化T细胞似乎充当了先锋,通过它们的由synNotch诱导的IL-2产生在肿瘤中引发增殖,然后协同性地启动CAR/TCR介导的持续性T细胞激活和杀伤。
综上所述,这些结果表明,有可能重新配置T细胞回路,以重建强大的抗肿瘤反应所需的关键输出(CAR/TCR激活和炎性细胞因子信号)。因此,这种类型的工程化局部细胞因子递送回路可能提供一种潜在的通用策略,以驱动有效的T细胞活性来对抗免疫抑制性的实体瘤。(生物谷 Bioon.com)
参考资料:
Greg M. Allen et al. Synthetic cytokine circuits that drive T cells into immune-excluded tumors. Science, 2022, doi:10.1126/science.aba1624.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


