Blood:第三代anti-CD19 CAR-T细胞在治疗B细胞非霍奇金淋巴瘤的1期临床试验中显示出疗效,并且没有神经毒性
来源:生物谷原创 2023-12-28 13:35
在一项新的研究中,来自新西兰马拉汉医学研究所和惠灵顿昭泰治疗有限公司(Wellington Zhaotai Therapies Limited)的研究人员公布了新型第三代抗 CD19 嵌合抗原受体 (
在一项新的研究中,来自新西兰马拉汉医学研究所和惠灵顿昭泰治疗有限公司(Wellington Zhaotai Therapies Limited)的研究人员公布了新型第三代抗 CD19 嵌合抗原受体 (CAR) T 细胞(anti-CD19 CAR-T细胞)疗法的1期剂量递增临床试验结果。相关研究结果于2023年11月28日在线发表在Blood期刊上,论文标题为“A Phase 1 Dose Escalation Trial of Third-Generation CD19-Directed CAR T-Cells Incorporating CD28 and Toll-like Receptor 2 (TLR2) Intracellular Domains for Relapsed or Refractory B-Cell Non-Hodgkin Lymphomas (ENABLE)”。

具有CD28协同刺激结构域的anti-CD19 CAR-T细胞,比如axicabtagene ciloleucel和brexucabtagene autoleucel,是治疗B细胞非霍奇金淋巴瘤最有效的CAR-T细胞疗法之一,但大约一半的受者会出现神经毒性(immune effector cell-associated neurotoxicity syndrome, ICANS, 免疫效应细胞相关神经毒性综合征),高达90%的受者会出现细胞因子释放综合征(cytokine release syndrome, CRS)。
这些作者开发出第三代自体anti-CD19 CAR-T细胞产品,该产品将 CD28 与TLR2共刺激结构域结合在一起。在临床前研究中,与仅有 CD28 协同刺激的 CAR 相比,添加 TLR2共刺激结构域的anti-CD19 CAR-T细胞产品保持或提高了疗效,同时降低了促炎细胞因子 IFN-γ 和 GM-CSF 的产生,而这两种细胞因子与 CRS 和 ICANS 有关联。
21名复发或难治性B细胞非霍奇金淋巴瘤患者在1期临床试验的剂量递增队列中接受了治疗,并完成了主要随访期。患者年龄中位数为57岁,19%为毛利人,之前平均接受过四种疗法。
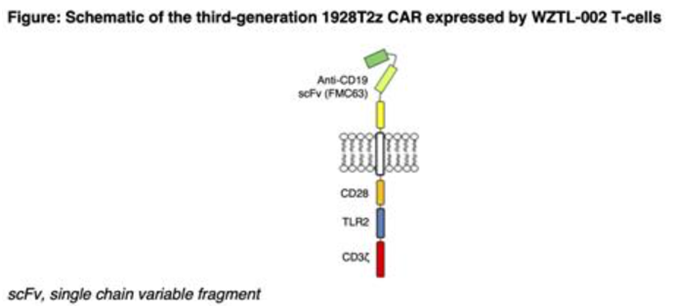
图片来自Blood, 2023, doi:10.1182/blood-2023-178872。
在5×104至1×106 CAR-T细胞/kg的剂量下,未出现剂量限制性毒性。13名患者(62%)出现了1级或2级CRS;没有出现严重(≥3级)CRS。值得注意的是,没有发生任何级别的 ICANS。所有剂量水平的患者都出现了临床反应,3个月完全反应率为52%。WZTL-002 CAR-T细胞扩增效果显著。建议2期临床试验的剂量范围为 5×105 至 1×106 cells/kg。此后,又有四名患者在剂量扩增队列中接受了这一剂量的治疗,并达到了DLT评估时间点;在这四名新增患者中,没有发生≥3级的CRS,也没有发生任何级别的ICANS。
马拉汉医学研究所临床主任Robert Weinkove博士说,“基于 CD28 的anti-CD19 CAR-T细胞疗法没有神经毒性,这一点非常了不起。在CD28和CD3ζ的基础上增加这种细胞内TLR2结构域会改变CAR-T细胞的细胞因子谱,这可能是我们临床发现的原因。我们正在招募剂量扩增队列,进行门诊管理并自动制造WZTL-002 CAR-T细胞。这有助于我们为2024年初的2期临床试验做准备,以评估更多患者的疗效和安全性。”
最初的含TLR2的CAR-T细胞是由中国广州生物医药与健康研究院与湖南昭泰医疗集团有限公司(Hunan Zhaotai Medical Group)合作开发的。2017 年,惠灵顿昭泰治疗有限公司成立,作为马拉汉医学研究所和湖南昭泰医疗集团的合资企业,为国际市场开发这项技术。2019年,结合CD28和TLR2共刺激的自体anti-CD19 CAR-T细胞疗法WZTL-002临床试验启动。2023 年,惠灵顿昭泰治疗有限公司与Reddy博士实验室签订了一份许可协议,以开发包含这种 CAR-T 细胞疗法。
惠灵顿昭泰治疗有限公司执行董事 Peter Lai 说,“这些成果是我们新型 CAR-T细胞技术开发和全球 CAR-T 细胞疗法未来的又一个激动人心的里程碑。将 CAR-T 细胞疗法推广到大型制药公司尚未涉足的市场,既是巨大的需求,也是巨大的机遇。WZTL-002的副作用降低,为满足这一尚未满足的需求创造了大好机会。”
这项剂量扩增队列研究的目标之一是与新西兰公司BioOra Limited合作,将CAR-T细胞的生产推向自动化平台。BioOra 董事会成员、CAR-T 细胞疗法先驱Carl June教授说,ENABLE 临床试验的1期 CAR-T细胞数据是治疗表达CD19的淋巴瘤向前迈出的一步。“Weinkove博士和他在马拉汉医学研究所的团队展示了与商业CAR-T细胞相同的疗效,但安全性似乎更胜一筹。这为他们的 CAR-T细胞项目的门诊治疗和管理以及扩大适应症奠定了基础。”(生物谷 Bioon.com)
参考资料:
Robert Weinkove et al. A Phase 1 Dose Escalation Trial of Third-Generation CD19-Directed CAR T-Cells Incorporating CD28 and Toll-like Receptor 2 (TLR2) Intracellular Domains for Relapsed or Refractory B-Cell Non-Hodgkin Lymphomas (ENABLE). Blood, 2023, doi:10.1182/blood-2023-178872.
Third-generation anti-CD19 CAR T-cells demonstrate efficacy without neurotoxicity in B-cell lymphoma phase 1 clinical trial
https://www.malaghan.org.nz/news-and-reports/news/third-generation-anti-cd19-car-t-cells-demonstrate-efficacy-without-neurotoxicity-in-b-cell-lymphoma-phase-1-clinical-trial/
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


