Science子刊:新方法改善CAR-T细胞的抗原敏感性
来源:本站原创 2021-11-17 13:55
嵌合抗原受体(CAR)修饰的T细胞(CAR-T)疗法在治疗淋巴瘤、白血病和多发性骨髓瘤方面是有效的,因为这些肿瘤细胞表达大量的靶抗原。然而,要实现这些血液恶性肿瘤的持久缓解,并将CAR-T细胞疗法扩展到实体瘤患者,将需要能够识别和消除靶抗原密度低的肿瘤细胞的CAR。嵌合抗原受体(CAR)旨在模拟激活的内源性T
2021年11月17日讯/生物谷BIOON/---嵌合抗原受体(CAR)修饰的T细胞(CAR-T)疗法在治疗淋巴瘤、白血病和多发性骨髓瘤方面是有效的,因为这些肿瘤细胞表达大量的靶抗原。然而,要实现这些血液恶性肿瘤的持久缓解,并将CAR-T细胞疗法扩展到实体瘤患者,将需要能够识别和消除靶抗原密度低的肿瘤细胞的CAR。
嵌合抗原受体(CAR)旨在模拟激活的内源性T细胞受体(TCR)并诱导对肿瘤抗原的细胞毒性反应。然而,TCR对肿瘤抗原的敏感性至少是CAR的100倍。这意味着CAR需要比TCR更多的肿瘤抗原来激活,从而导致许多患者被排除治疗或治疗失败和疾病复发。
为了设计具有较低激活阈值的CAR,或者说具有更好的抗原敏感性的CAR,来自美国弗雷德-哈金森癌症研究中心等研究机构的研究人员直接比较了原代人类T细胞中的TCR和CAR信号传导。全局磷酸化蛋白质组分析显示,关键的T细胞信号蛋白---比如构成了T细胞辅助受体的一部分的CD3δ、CD3ε和CD3γ,以及TCR衔接蛋白LAT---在CAR刺激下要么不被磷酸化,要么只被弱磷酸化。相关研究结果近期发表在Science Signaling期刊上,论文标题为“Comparative analysis of TCR and CAR signaling informs CAR designs with superior antigen sensitivity and in vivo function”。

这些作者利用他们获得的磷酸化蛋白质组数据设计了BB/εPRS_ITAM/ζ CAR和BB/ζ/link_GRB2 CAR。与BB/ζCAR相比,这些新的CAR设计在体外有更高的抗原反应性,但不如28/ζCAR敏感。BB/εPRS_ITAM/ζ CAR的敏感性提高被CD3ε PRS和ITAM结构域的突变所取消,这意味着信号传导是功能改善的机制。
这些新设计的CAR能够更好地与CD3ε和LAT结合,导致在低密度抗原环境下增强体外T细胞激活,并改善在淋巴瘤、白血病和乳腺癌体内模型中的疗效。这些研究结果为设计更有力地激活T细胞辅助受体和衔接蛋白的新型CAR提供了依据,从而使CAR-T细胞在细胞培养物中对低抗原密度的肿瘤细胞作出更有效的反应,并减少小鼠体内的肿瘤负荷和死亡率。
这些新设计的CAR没有一种可以接近天然TCR的敏感性,这说明TCR属性的重要性,如降低亲和力、连续触发、机械刺激感受器功能和辅助受体结合,这些属性都很难被设计到CAR构造体中。
然而,在血液恶性肿瘤和乳腺癌的四种异种移植小鼠模型中,这些新设计的CAR与BB/ζ CAR相比,具有同等或更好的抗肿瘤活性。此外,在三种血液学恶性肿瘤模型中,这些新设计的CAR比28/ζCAR更有优势,这与抑制性受体的较少上调和较好的持久性相吻合。因此,这些磷蛋白组学数据使得这些作者能够设计出具有更好的体外抗原敏感性和体内功能的新型CAR。
这些作者使用双特异性T细胞的方法的一个局限性是,这项新的研究仅检测了CD8+T细胞,因为CAR和TCR之间的比较使用的是对Epstein-Barr病毒(EBV)的I类MHC限制性反应。还需要进行额外的研究,以确定这些结果是否可以扩展到临床CAR-T细胞产品,这些产品通常来自包含CD8+ T细胞和CD4+ T细胞以及初始T细胞(naïve T cell)和记忆T细胞的大量T细胞群体。基底CAR磷酸化和抗原非依赖性信号传导(tonic signaling)似乎是具有CD28共刺激结构域的CAR的共同特性;然而,这项新研究中使用的28/ζCAR构造体在没有抗原的情况下并没有引起足够的抗原非依赖性信号传导以上调PD-1或诱导组成性生长。
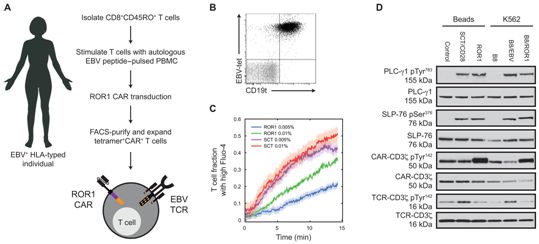
双特异性T细胞和磁珠能够分析单细胞群体中的TCR和CAR信号。图片来自Science Signaling, 2021, doi:10.1126/scisignal.abe2606。
总之,这些研究结果表明,“第二代”BB/ζ CAR的功能可以通过合理插入新的信号传导结构域和蛋白结合结构域而得到增强。插入这样的结构域可以改善受体的信号传导,其方式与增加或选择替代性共刺激结构域不同,后者到目前为止一直是CAR领域的一个主要的优化重点。这项新研究的一个重要意义是,未来的CAR可能会受益于“精简”的功能性结构域,这些功能性结构域只包含那些对驱动信号传导和/或蛋白招募至关重要的肽序列。对于CD3ε来说,部分去除胞内结构域产生的CAR表达水平更高,而且比含有CD3ε整个胞内结构域的CAR功能更强。在这种可能性成为现实之前,科学家们必须更好地了解T细胞信号传导胞内结构域中的单个肽序列如何促进T细胞的激活和效应反应。因此,调控CAR结构的新方法仍然是一个重要的研究领域。
虽然CD3ε和GRB2是这些作者获得的磷酸化蛋白质组数据集中得出的两种有代表性的信号传导结构域,但是该数据集提供了大量的额外信息来推断出代谢适能(metabolic fitness)和T细胞功能的其他方面。利用合成生物学和测序技术的进步的高通量筛选策略应该在未来的研究工作中提高这类研究的可行性。(生物谷 Bioon.com)
参考资料:
Alexander I. Salter et al. Comparative analysis of TCR and CAR signaling informs CAR designs with superior antigen sensitivity and in vivo function. Science Signaling, 2021, doi:10.1126/scisignal.abe2606.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。



