梳理阿尔茨海默病研究进展
来源:本站原创 2021-09-30 23:46
2021年9月30日讯/生物谷BIOON/---阿尔茨海默病(Alzheimer's disease, AD)是一种起病隐匿的渐进性发展的神经系统退行性疾病。临床初症状表现为记忆力下降、日常生活能力产生障碍,最终将卧床不起、大小便失禁,完全需要依赖家人的照顾,病因迄今未明。在65岁以前发病,称为早老性痴呆;在65岁以后发病,称为老年性痴呆。目前只能通过药物缓
2021年9月30日讯/生物谷BIOON/---阿尔茨海默病(Alzheimer's disease, AD)是一种起病隐匿的渐进性发展的神经系统退行性疾病。临床初症状表现为记忆力下降、日常生活能力产生障碍,最终将卧床不起、大小便失禁,完全需要依赖家人的照顾,病因迄今未明。在65岁以前发病,称为早老性痴呆;在65岁以后发病,称为老年性痴呆。目前只能通过药物缓解大脑萎缩,还没有治愈的方法,确诊后的平均生存期为10年。据估计,我国现有1000多万老年性痴呆患者,数量居全球之首,占全球总患者的1/4,而且每年平均有30万新发病例。
正因为此,AD已成为大脑研究的焦点。越来越明显的是,科学家们还需开展更多的研究,这是因为到2050年,全球AD患者人数预计从如今的0.44亿增加到1.355亿。日益增加的AD全球负担将会导致重大的经济和社会成本,而且全世界的政府---如英国、美国和澳大利亚---已投入大量研究资金以便努力抵抗这种疾病。
1.Glia:小分子抑制剂SRI-42127强效阻止神经炎症,有望治疗一系列神经退行性疾病
doi:10.1002/glia.24094
神经炎症可以恶化中风、创伤性脑损伤或脊髓损伤的结果,并加速诸如肌萎缩性侧索硬化症(ALS)、帕金森病或阿尔茨海默病之类的神经退行性疾病。这表明限制神经炎症可能代表了一种有希望的治疗由神经炎症驱动的神经系统疾病和神经性疼痛的新方法。
在一项新的临床前研究中,美国阿拉巴马大学伯明翰分校医学博士Peter King和医学博士Burt Nabors及其同事们发现他们的小分子药物SRI-42127能够有效地减弱神经炎症的触发因素。这些在胶质细胞培养物和小鼠中的实验如今打开了在急性和慢性神经损伤模型中测试SRI-42127的大门。相关研究结果于2021年9月17日在线发表在Glia期刊上,论文标题为“SRI-42127, a novel small molecule inhibitor of the RNA regulator HuR, potently attenuates glial activation in a model of lipopolysaccharide-induced neuroinflammation”。
图片来自Pixabay/CC0 Public Domain。
此外,SRI-42127抑制了小鼠大脑中的小胶质细胞的激活,它削弱了中性粒细胞和单核细胞从血脑屏障外招募到中枢神经系统。中性粒细胞和单核细胞进入中枢神经系统可以加剧大脑或脊髓的炎症。总之,SRI-42127穿透了血脑屏障并迅速抑制了神经炎症反应。
2.Nature子刊:我国科学家发现1070纳米的光脉冲有望治疗阿尔茨海默病
doi:10.1038/s41377-021-00617-3
阿尔茨海默病(AD)与记忆、语言、定向和其他认知技能的进行性损害有关,在整个病程中影响日常活动,最终导致死亡。目前迫切需要有效的治疗策略来治疗AD。光生物调节作用(photobiomodulation, PBM)是指在可见光和近红外(NIR)光谱中的低功率光(1~500毫瓦)触发细胞和组织的有益生物过程,从而导致生理改变。PBM被认为是治疗AD的一种有希望的方法,而它的确切机制仍不清楚。
在一项新的研究中,来自中国上海交通大学、北京大学和复旦大学的研究人员进行了具有特定刺激模式的PBM来治疗AD小鼠模型。他们探讨了1070纳米的光脉冲在10赫兹下对APP/PS1小鼠的治疗效果。这项研究中使用的参数是基于他们之前的一项研究。相关研究结果于2021年9月8月在线发表在Light: Science & applications期刊上,论文标题为“Microglia modulation with 1070-nm light attenuates Aβ burden and cognitive impairment in Alzheimer’s disease mouse model”。
对于1070纳米光治疗,将AD+10赫兹和AD+40赫兹组的小鼠置于1070纳米光照射装置中,每天下午7点接受6分钟的照射,连续60天,波长为1070±50纳米。在治疗期间,小鼠可以活动、探索和休息。AD组和WT组的小鼠经历了与治疗组相同的程序,只是1070纳米的光照射装置保持关闭。
在光处理后,他们探索了光对处于不同阶段的AD小鼠的影响。他们证实,1070纳米的光通过减少Aβ载量改善了AD小鼠的记忆和认知能力。此外,他们发现1070纳米光可以触发小胶质细胞反应,而不是星形细胞反应,以促进Aβ清除。据观察,在光刺激后,血管周围的小胶质细胞减少,而血管密度增加。他们发现,血管密度的增加也促进了Aβ的清除。
3.PNAS:阻断Aβ纤维顶端可能成为治疗阿尔茨海默病的新方法
doi:10.1073/pnas.2110995118
治疗阿尔茨海默病的进展一直缓慢得令人沮丧。然而,小规模的挫折可能会导致一种新的治疗方法。在一项新的研究中,来自美国休斯顿大学、莱斯大学和普林斯顿大学的研究人员通过实验和计算发现作为大脑中大量存在的小分子,β淀粉样蛋白(Aβ)肽在“停靠并锁定”在生长中的纤维顶端(fibril tip)时,会经历几个受挫的中间阶段。相关研究结果发表在2021年9月21日的PNAS期刊上,论文标题为“Frustrated peptide chains at the fibril tip control the kinetics of growth of amyloid-β fibrils”。
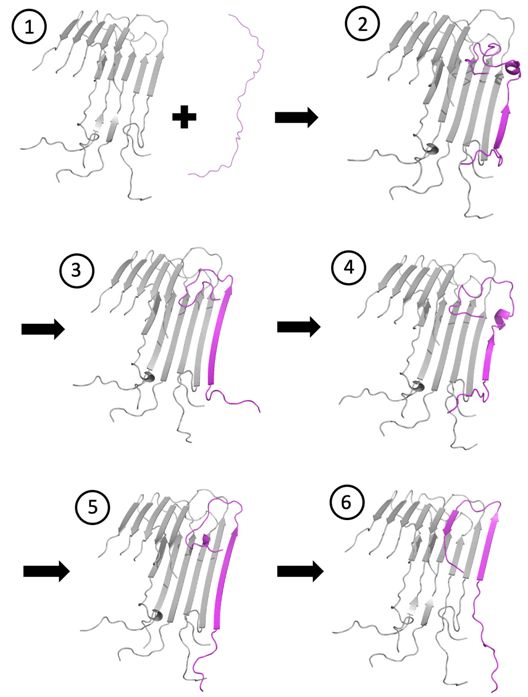
莱斯大学计算模型显示Aβ肽(洋红色)是如何停靠并锁定在Aβ纤维上的。模拟结果显示了步骤2到步骤5的中间构象,结合受挫的迹象可能提供了新的治疗机会。图片来自Kaitlin Knapp/Rice University。
Vekilov说,“发生了一件怪事。尿素使Aβ纤维不那么稳定,这意味着Aβ纤维中分子之间的键变得不那么牢固。但它也使它们生长得更快。这是一个非常严重的矛盾,违反了化学的经验性规则。但有经验法则,也有基本定律。我们认为,这试图告诉我们一些事情。”
Vekilov说,进一步的实验表明,尿素“破坏了错误的肽键的稳定性。它使Aβ纤维生长得更快,但也向我们展示了受挫的中间步骤。最重要的是我们现在有证据表明,一个受挫的、无序的冠状肽链试图对接和锁定在Aβ纤维的末端,而这些是药物可靶向的靶标(druggable target)。”
4.Aging:高压氧疗法有望预防阿尔茨海默病
doi:10.18632/aging.203485
全世界大约有5千万人患有阿尔茨海默病或其他相关形式的痴呆症。阿尔茨海默病导致记忆丧失和认知功能受损,是老年人中最常见的痴呆症原因。虽然某些治疗方法可以帮助减轻症状,有时还可以减缓疾病进展,但目前还没有办法预防或治愈阿尔茨海默病。在此背景下,来自以色列特拉维夫大学的研究人员在一项新的研究中开发出一种逆转该疾病前兆的过程,为新的预防疗法提供了一个有希望的基础。这标志着一种非药物疗法首次被证明能有效阻止导致阿尔茨海默病产生的核心生物过程,为我们能够对抗西方世界的最大挑战之一带来了希望。相关研究结果于2021年9月9日在线发表在Aging期刊上,论文标题为“Hyperbaric oxygen therapy alleviates vascular dysfunction and amyloid burden in an Alzheimer’s disease mouse model and in elderly patients”。
通过使用高压氧疗法(hyperbaric oxygen therapy, HBOT),即受试者在一个特殊的高压室中呼吸100%的氧气,这些作者能够逆转与阿尔茨海默病的生物特征相关的大脑损伤。论文通讯作者、特拉维夫大学的Uri Ashery教授说,“经过一系列高压氧治疗后,已出现记忆丧失的老年患者显示出大脑血流的改善,以及认知能力的真正提高。”
这些作者设计的新方法明确地改善了通常与阿尔茨海默病有关的特征。具体来说,高压氧治疗的结果是:(1)平均有16.5%的患者记忆力得到改善;(2)16%~23%的病例血流增加;(3)6%的患者的注意力和集中力得到改善;(4)10.3%的病例提高了信息处理速度。
5.PLoS Biol:肝脏中产生的β淀粉样蛋白可导致大脑神经变性,是导致阿尔茨海默病的一种潜在因素
doi:10.1371/journal.pbio.3001358
在一项新的研究中,澳大利亚科廷大学的John Mamo及其同事们发现肝脏制造的β淀粉样蛋白(beta-amyloid protein, Aβ)可导致大脑的神经变性。由于这种蛋白质被认为是阿尔茨海默病(AD)产生的关键促进因素,这一结果表明,肝脏可能在这种疾病的发病或进展中发挥重要作用。相关研究结果于2021年9月14日发表在PLoS Biology期刊上,论文标题为“Synthesis of human amyloid restricted to liver results in an Alzheimer disease–like neurodegenerative phenotype”。

血浆和大脑中载脂蛋白B和Aβ的浓度。图片来自PLoS Biology, 2021, doi:10.1371/journal.pbio.3001358。
在这项新的研究中,这些作者克服了这一挑战,开发出一种只在肝细胞中产生人类Aβ的小鼠。他们发现,这种蛋白质由富含甘油三酯的脂蛋白在血液中携带,就像它在人类中一样,并从外周器官进入大脑。他们发现,这些小鼠出现了神经变性和脑萎缩,并伴随着神经血管炎症和脑毛细血管功能障碍,后两者症状在阿尔茨海默病中普遍存在。受影响的小鼠在一项取决于海马体功能的学习测试中表现不佳,其中海马体是形成新记忆的重要大脑结构。
这些研究结果表明,外周器官产生的Aβ有能力导致神经变性,并表明肝脏中产生的Aβ是人类罹患阿尔茨海默病(AD)的一个潜在促进因素。如果这种促进是巨大的,那么这些发现可能对理解AD有重大影响。迄今为止,大多数AD模型都集中在大脑过度产生Aβ,这模拟了人类AD的罕见遗传病例。但对于绝大多数的AD病例来说,大脑中的Aβ过度产生被认为不是AD病因的核心。相反,生活方式因素可能起着更重要的作用,包括可能加速肝脏产生Aβ的高脂肪饮食。
6.Science子刊:揭示阿尔茨海默病中大脑突触退化背后的关键机制
doi:10.1126/sciadv.abh2307
健康的成年人大脑被赋予了大量的突触,这些突触在神经细胞之间传递信号,以实现整个神经系统的通信、信息处理和存储。除了在大脑学习新信息或技能的动态时期,“谷氨酸能(glutamatergic)”突触---神经元用来相互激活的主要突触类型---的数量在成年人中基本保持不变。在阿尔茨海默病等脑部疾病中,这些承载着我们宝贵记忆的突触连接被认为过早地分解并消失。这种突触退化被认为早在记忆丧失之前就开始了,并随着疾病的进展而加速发生。神经退行性疾病中突触退化的原因一直没有得到很好的理解,主要是因为科学家们还没有解开通常在我们的一生中将这些微小的突触(平均直径为一微米)维系在一起的关键机制。
如今,在一项新的研究中,美国加州大学圣地亚哥分校生物科学系博士后研究员Bo Feng、Yimin Zou教授及其同事们发现了人们长期寻找的维持谷氨酸能突触的机制。基于这一基本发现,他们确定了驱动与β淀粉状蛋白相关的突触退化的主要成分。β淀粉状蛋白由淀粉样前体蛋白(app)衍生的长36~43个氨基酸的肽,是阿尔茨海默病患者大脑中发现的淀粉样斑块的主要成分。相关研究结果近期发表在Science Advances期刊上,论文标题为“Planar cell polarity signaling components are a direct target of β-amyloid–associated degeneration of glutamatergic synapses”。
在一系列实验中,这些作者发现β淀粉状蛋白低聚物与Celsr3结合,并允许Vangl2更有效地分解突触,这可能是通过削弱Celsr3和Frizzled3之间的相互作用来实现的。当他们从神经元中移除Vangl2时,他们发现无论是在体外培养的神经元还是在暴露于β淀粉状蛋白低聚物的动物中,β淀粉状蛋白都不能再导致突触退化。作为PCP通路中与与Frizzled3和Vangl2相互作用的调节因子,Ryk也被发现存在于成体突触中,它的功能与Vangl2相同,可介导突触分解。他们发现,使用功能阻断抗体阻断Ryk可以保护突触免受β淀粉状蛋白诱导的退化。
为了进一步测试这种基础信号通路是阿尔茨海默病中突触退化的主要靶标这一假设,Zou实验室使用了一种著名的β淀粉状蛋白病理小鼠模型,即5XFAD小鼠。这种转基因小鼠携带五个导致阿尔茨海默病的人类突变,因此表现出严重的突触退化和认知功能丧失的症状。他们发现,通过基因敲除去除成体神经元中的Ryk,可以保护突触并保存5XFAD小鼠的认知功能。输注阻断Ryk抗体的功能也能保护5XFAD小鼠的突触和保存认知功能,这表明Ryk抗体是一种潜在的治疗剂。
7.Nat Commun:米色脂肪在保护大脑免患痴呆中起着重要的作用
doi:10.1038/s41467-021-24540-8
米色被认为是一种镇静的油漆颜色。在一项新的研究中,美国奥古斯塔大学乔治亚医学院神经科学家Alexis M. Stranahan博士和她的同事们发现新的证据表明,米色脂肪对大脑有类似的影响,可以降低与更常见的白色脂肪有关的炎症,并预防痴呆。具体而言,他们发现,在 "梨形 (pear shaped)"人的皮下脂肪中,通常与白色脂肪细胞混合在一起的米色脂肪细胞介导皮下脂肪的大脑保护作用。相关研究结果近期发表在Nature Communications期刊上,论文标题为“Beige adipocytes mediate the neuroprotective and anti-inflammatory effects of subcutaneous fat in obese mice”。

缺乏米色脂肪的转基因小鼠因饮食性肥胖而表现出加速的神经炎症。图片来自Nature Communications, 2021, doi:10.1038/s41467-021-24540-8。
在正常情况下,小鼠在高脂肪饮食下需要三个月左右的时间才能显示出他们在敲除米色脂肪的小鼠身上观察到的那种反应。为了进一步探索米色脂肪的影响,他们还将年轻、瘦的健康小鼠的皮下脂肪移植到其他正常但如今肥胖且在摄入高脂肪饮食10至12周后出现了痴呆样行为的小鼠的内脏腔室。移植皮下脂肪的结果是改善了记忆,恢复了海马体中基本正常的突触可塑性,其中了海马体是大脑深处的学习和记忆中心。Stranahan 和她的同事写道,这些积极的变化取决于捐赠者皮下脂肪中的米色脂肪细胞。另一方面,来自敲除米色脂肪的年轻的瘦的小鼠的皮下脂肪移植并没有改善肥胖小鼠的认知能力,包括通过严格的客观测量指标(如神经元之间的电活动增加)所显示的那样。
8.PNAS:揭示大脑胆固醇调节阿尔茨海默病中的β淀粉样蛋白斑块产生机制
doi:10.1073/pnas.2102191118
在一项新的研究中,来自美国斯克里普斯研究所、弗吉尼亚大学和华盛顿大学的研究人员利用先进的成像方法揭示了阿尔茨海默病相关蛋白β淀粉样蛋白(amyloid beta, Aβ)在大脑中的产生是如何受到胆固醇的严格调控的。这些发现推进了对阿尔茨海默病如何产生的理解,并强调了大脑中长期以来未被重视的胆固醇的作用,此外,也有助于解释为什么遗传学研究将阿尔茨海默病风险与一种叫做载脂蛋白E(apoE)的胆固醇转运蛋白联系起来。相关研究结果发表在2021年8月17日的PNAS期刊上,论文标题为“Regulation of beta-amyloid production in neurons by astrocyte-derived cholesterol”。论文通讯作者为斯克里普斯研究所分子医学系副教授Scott Hansen博士和弗吉尼亚大学医学院医学系助理教授Heather Ferris博士。论文第一作者为Hansen实验室的研究生Hao Wang。
Hansen博士说,“我们发现,胆固醇在神经元中基本上是作为一种信号发挥作用的,它决定了有多少Aβ被制造出来---因此,将胆固醇携带到神经元的apoE影响阿尔茨海默病风险应该是不奇怪的。”
这些作者随后在年老的“3xTg-AD”小鼠身上做了一系列实验,其中这些小鼠经过基因改造后过度产生Aβ,形成Aβ斑块,并广泛用于模拟阿尔茨海默病。他们发现,当关闭这些小鼠大脑中的星形胶质细胞产生胆固醇时,Aβ的产生急剧下降到接近正常,Aβ斑块几乎消失了。通常在这些小鼠身上观察到的另一个典型的阿尔茨海默病迹象是一种叫做tau的神经元蛋白的缠结聚集物的积累,不过,它们也消失了。
9.Nat commun:内溶酶体Aβ浓度和pH值是引起阿尔茨海默病的重要因素
doi:10.1038/s41467-021-24900-4
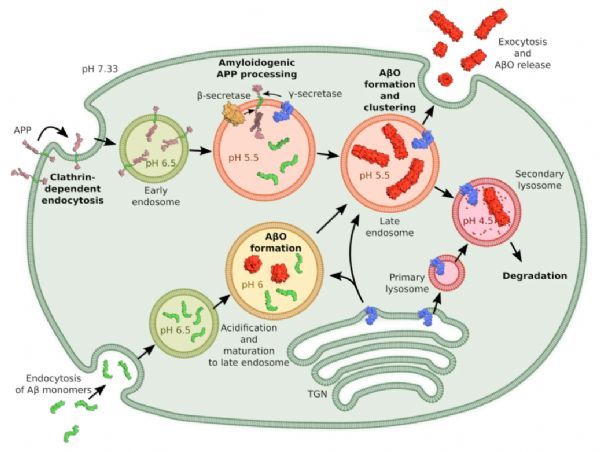
细胞内APP加工、Aβ摄取和AβO形成的方案。
研究人员从细胞外pH降低到溶酶体内pH时,发现AβO的组装速度加快了8000倍,但同时形成了淀粉样纤维。pH诱导AβO的形成和高溶酶体Aβ浓度共同使Aβ42在生理条件下广泛形成AβO。为了测试dimAβ AβOs产生的生物学效应,研究人员分析了它们与树突棘的结合过程、直接细胞毒性、诱导Tau错分类的能力,以及对神经元功能的影响。在中性pH下,ThT监测的dimAβ的组装动力学显示了在浓度(COC)~1.5μM以上的双相行为,第一相对应于AβOs的无延迟齐聚,第二相反映淀粉样原纤维的形成。另外,Tau错分随时间的增加,说明dimAβ AβOs具有显着的动力学稳定性和持续性,和诱导病理性Tau错分的能力。通过测量神经元培养过程中的自发钙振荡行为,发现dimAβ AβOs处理24 h后钙振荡显着降低,表明dimAβ AβOs损害了神经元的活性和功能。研究人员证明了AβO靶向树突状棘,有效诱导Tau错分类(Tau病的关键因素)以及神经元活动损伤。
此外,研究人员发现,Aβ42和dimAβ均在溶酶体内腔室中积累,且内溶酶体pH促进AβO组装,但延迟淀粉样原纤维的形成。Aβ42在溶酶体条件下可以进行AβO组装。这些结果表明,内体/溶酶体系统是病理机制相关AβOs的主要组装位点。
10.Cell Stem Cell:靶向miR-132有望让阿尔茨海默病患者的大脑返老还童
doi:10.1016/j.stem.2021.05.001
阿尔茨海默病(Alzheimer's disease, AD)是仅次于心脏病、肿瘤和中风而导致死亡的第四大疾病,已成为人类目前和未来所面临的全球公共卫生和社会保健的最大挑战之一。目前的治疗策略不能预防、减缓或治愈这种病理。
在一项新的研究中,来自荷兰神经科学研究所的研究人员鉴定出一种称为miR-132的小RNA分子,它可以用来使AD模型动物的大脑返老还童并抵消记忆丧失。相关研究结果于2021年5月24日在线发表在Cell Stem Cell期刊上,论文标题为“Restoring miR-132 expression rescues adult hippocampal neurogenesis and memory deficits in Alzheimer’s disease”。
在这项研究中,这些作者着手解决miR-132是否能调节健康大脑和AD大脑的海马体中的成体神经发生。利用不同的AD小鼠模型、体外培养的人类神经干细胞和死后的人类大脑组织,他们发现这种小RNA分子对成年海马体的神经发生过程是必需的。降低成年小鼠大脑或培养皿中人类神经干细胞中的miR-132水平会损害新神经元的生成。然而,在AD小鼠中恢复miR-132的水平可以拯救神经发生缺陷,并抵消与成体神经发生缺陷有关的记忆损伤。
这些作者为开发恢复AD中的成体神经发生的潜在疗法提供了一个概念验证。这些作者的下一个目标是系统地评估靶向miR-132作为AD治疗策略的有效性和安全性。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


