Nat Commun:重磅!科学家利用人类干细胞制造出了胚胎样结构!
来源:本站原创 2021-09-26 21:40
来自加州理工学院等机构的科学家们通过研究利用人类干细胞创造出了胚胎样的结构,相比由精子和卵子结合形成的自然胚胎不同,这种结构是由所谓的多能干细胞结合所形成,这些多能干细胞拥有发育为特殊类型细胞的能力;尽管这些胚胎样结构与真正的胚胎存在一些关键差异,但创造它们的技术对于回答有关人类发育的公开问题至关重要,而这并不需要所捐赠的胚胎。
理解人类的发展具有基本的生物学和临床重要性,尽管这一点非常重要,但人类胚胎发育背后的机制在很大程度上仍然是未知的;对人类胚胎的研究对于理解人类发育的早期阶段很关键;目前这类研究是在接受体外受精的个体自愿捐赠的剩余胚胎中所进行的,然而,这类研究受限于胚胎的可获得性以及严格的国际伦理时间限制,即允许胚胎在实验室中发育多长时间(最多14天)。
近日,一篇发表在国际杂志Nature Communications上题为“Reconstructing aspects of human embryogenesis with pluripotent stem cells”的研究报告中,来自加州理工学院等机构的科学家们通过研究利用人类干细胞创造出了胚胎样的结构,相比由精子和卵子结合形成的自然胚胎不同,这种结构是由所谓的多能干细胞结合所形成,这些多能干细胞拥有发育为特殊类型细胞的能力;尽管这些胚胎样结构与真正的胚胎存在一些关键差异,但创造它们的技术对于回答有关人类发育的公开问题至关重要,而这并不需要所捐赠的胚胎。
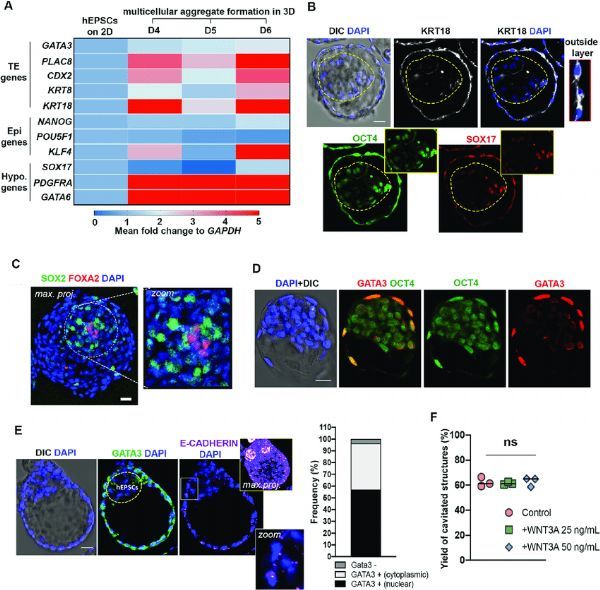
图片来源:https://www.nature.com/articles/s41467-021-25853-4
这些结构由一类特殊的多能干细胞所形成,这些干细胞能产生不同类型的细胞,随后自组装形成一种形态明显让人联想到胚胎形态的特殊结构,胚胎有着不同胚胎组织和胚胎外组织。这些多能干细胞最初是由其他研究人员从一个真正的人类胚胎中分离出来的,此后一直在实验室环境中保存着,值得注意的是,当合适的环境条件支持时,这些细胞仍然能够“记住”如何组装成为胚胎。
研究者Zernicka-Goetz说道,组装胚胎基本结构的能力似乎是这些最早的胚胎细胞的一个内在属性,其根本无法忘记;尽管如此,要么其记忆不是绝对精准,要么研究人员目前还没有帮助细胞恢复记忆的最佳方法。在研究人员能够让人类干细胞达到与其相当的小鼠干细胞对应的发育精确度之前,他们仍有进一步的工作需要去完成。培养的多能干细胞能展现出多能状态的动态谱,并能反映在体内植入前到植入后的发展阶段,目前的研究中,研究人员旨在通过开发一系列措施,使得他们能够重建人类早期发育的时空谱系分化以及自我组装,从而就能利用所报道的hEPSCs(人类扩大多能干细胞)的双能性。研究人员在3D培养基平台中评估了hEPSCs模拟早期胚胎细胞命运的多分化潜能;研究结果表明,研究人员所建立的基于hEPSC的系统能促进hEPSCs自组装为在形态上与人类囊胚和植入期周围胚胎有一些相似之处的结构,并在一定程度上具有谱系规范,然而他们也发现,其细胞谱系组成并不是完善的,这些细胞主要会采用一种中间的转录状态。
囊胚谱系的说明。
图片来源:Sozen, B., et al. Nat Commun 12, 5550 (2021). doi:10.1038/s41467-021-25853-4
本文研究在hEPSC衍生结构的分子和表观遗传可塑性方面还存在一定的局限性,从而就会导致重要基因(比如GATA3、SOX2和SOX17基因)的弱激活,进而导致无效的谱系规范。最近研究人员描述了多种可替代的方法来使用原始或诱导多能干细胞产生人类囊胚样的结构,在这些报告中,研究人员所得到的结构在线了囊胚的整体形态,同时其还具有内部的细胞团和囊腔,且与本文中研究人员所描述的结构相似。同样具有适当的结构形成,且具有一定的空腔和内部细胞团,人类原始囊胚样结构的形成率为9.4%-12.8%,而人类诱导多能干细胞所产生的结构的形成率则为5.8%-18%。
尽管诱导多能干细胞所衍生的结构似乎具有形态学和转录组织,但科学家们对于滋养外胚层样细胞的身份提出了疑问,因为其似乎与报道的羊膜样细胞更为相似;这一研究发现结合本文中的研究结果,研究者提出,在干细胞衍生的人类胚胎发育的模型中,有潜力的形态和细胞行为或与转录细胞身份之间存在一定的脱节现象,本文研究中,研究人员展示了产生形态相似结构但基因表达模式却大相径庭的能力,这突出了这些模型中形态和基因表达的非耦合性,当然了,这些都有待于后期研究人员进一步探索研究。
培养中的hEPSC衍生的囊性结构或能展示出植入样形态重塑。
图片来源:Sozen, B., et al. Nat Commun 12, 5550 (2021). doi:10.1038/s41467-021-25853-4
从干细胞产生胚胎样结构的能力意味着并不需要额外捐赠的胚胎了,此外,这类结构还能被研究人员大量创建,因此,该模型系统能够帮助深入理解早期胚胎的发育过程,而不受人类胚胎有限可用性的限制;比如,其将可能会干扰特定的基因表达,并研究由此对发育过程所产生的影响,此外,该系统还能用来理解不同的细胞组分如何在非常早期的阶段来协调其发展,以及这种细胞串扰对后期发育阶段的影响效应。研究者提出,hEPSCs并不等同于全能的胚胎,其只能部分指定胚胎细胞的后代,这或许反映了不同的分子轨迹以及这些细胞所采用的中间状态,这就导致了本研究中研究者所观察到的不适当分化的细胞的产生;尽管如此,这些细胞也能够产生多细胞结构,从而展现出一些关键的形态特征以及类似于早期人类自然胚胎的模式。
因此,研究人员所提出的系统或许可能提供一种可替代的途径,从而就有可能被应用于体外的全功能胚胎样平台中。综上,本文研究结果表明,研究人员所开发的这种新型干细胞平台或许对于理解胚胎发育的干细胞模型提供了新的线索和深入的见解。(生物谷Bioon.com)
原始出处:
Sozen, B., Jorgensen, V., Weatherbee, B.A.T. et al. Reconstructing aspects of human embryogenesis with pluripotent stem cells. Nat Commun 12, 5550 (2021). doi:10.1038/s41467-021-25853-4
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。