中国神经母细胞瘤新药!新型GD2靶向抗体Danyelza被国家药监局(NMPA)纳入优先审评,已在美国上市!
来源:本站原创 2021-09-16 07:42
Danyelza于2020年11月在美国上市,是一款靶向神经节苷脂GD2的突破性药物。
2021年09月15日讯 /生物谷BIOON/ --Y-mAbs Therapeutics是一家专注于开发和商业化新型抗体疗法治疗癌症的生物制药公司。近日,该公司宣布,其合作伙伴赛生药业(SciClone)发布公告称,中国国家药品监督管理局(NMPA)药品审评中心(CDE)已将Danyelza(naxitamab,那昔妥单抗)的上市许可申请(BLA)纳入优先审评,拟定适应症为治疗复发性或难治性高危神经母细胞瘤患者。
2021年7月初,赛生药业与Y-mAbs宣布向NMPA正式递交Danyelza的上市许可申请(BLA)。Danyelza可与粒细胞-巨噬细胞集落刺激因子(GM-CSF)联合治疗对既往治疗表现出部分缓解、轻微缓解或疾病稳定的复发/难治性高危神经母细胞瘤儿童(1岁及以上)和成人患者。
2020年11月,Danyelza获得美国FDA加速批准上市。该加速批准基于总缓解率(ORR)及缓解持续时间(DOR)的临床获益。之前,FDA已授予了Danyelza优先审查资格、孤儿药资格(ODD)、突破性药物资格(BTD)、罕见儿科疾病资格(RPDD)。
2020年12月,赛生药业与Y-mAbs达成了独家无限期授权许可协议,获得2款产品Danyelza和omburtamab在大中华地区(包括中国大陆、中国香港、中国澳门、中国台湾)的独家合作开发和商业化权利。omburtamab是Y-mAbs的一款主要候选产品,经批准后可用于治疗儿童中枢神经系统/软脑膜转移的神经母细胞瘤。赛生药业将负责这2款产品在大中华区的研发、注册和商业化。
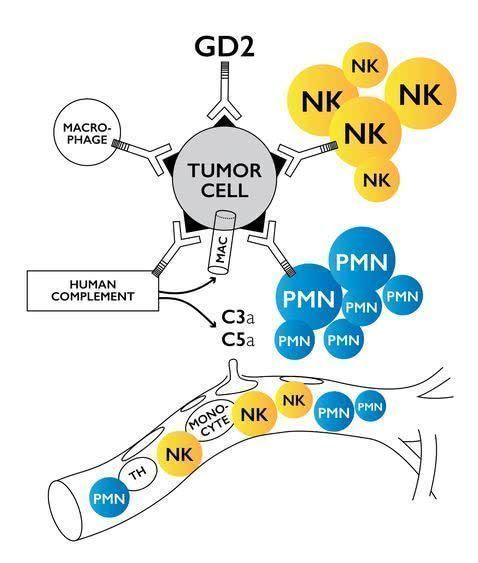
naxitamab作用机制(图片来源:Y-mAbs公司网站)
神经母细胞瘤是一种极具侵袭性的肿瘤,是婴幼儿最常见的肿瘤之一,尽管近年来强化多模式治疗已提高了生存率,但幸存者有很高的复发风险。
Danyelza是一种靶向神经节苷脂GD2的人源化单克隆抗体,GD2抗原在各种神经外胚层来源的肿瘤和肉瘤中呈现高表达,包括神经母细胞瘤、黑色素瘤和骨肉瘤等肿瘤。Danyelza通过与肿瘤细胞表面的GD2抗原结合,能够触发抗体介导的细胞毒性反应并激活免疫系统中的补体系统,从而达到杀伤肿瘤的效果。目前,Danyelza也正被开发用于治疗骨肉瘤以及其他GD2阳性肿瘤。
在美国,FDA批准Danyelza是基于2项关键2期研究(201和12-230)的安全性和有效性数据。这是2项开放标签、单臂临床试验,在年龄≥1岁、对既往治疗显示表现出部分缓解、轻微缓解或疾病稳定、骨骼或骨髓中有难治或复发性疾病的高危神经母细胞瘤患者中开展。
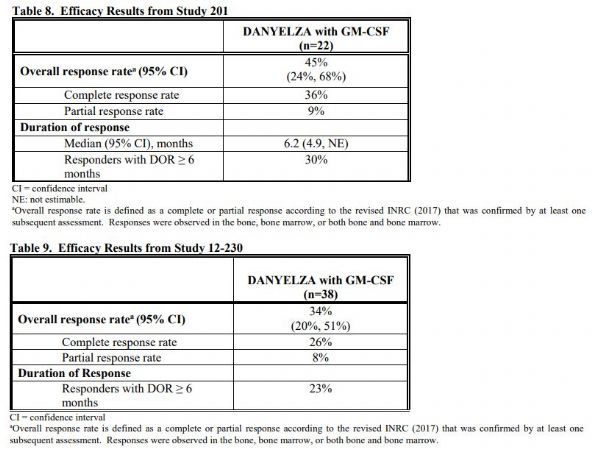
Danyelza临床数据数据
201研究(NCT03363373)中,22例患者纳入疗效分析,64%有难治性疾病、36%有复发性疾病,中位年龄为5岁(范围:3-10岁)。结果显示,Danyelza联合GM-CSF治疗的总缓解率(ORR)为45%、完全缓解率(CR)为36%、部分缓解率(PR)为9%。在有治疗反应的患者中,30%的患者缓解持续时间(DOR)≥6个月。
12-230研究(NCT01757626)中,38例患者纳入疗效分析,55%有复发性神经母细胞瘤、45%有难治性疾病,中位年龄为5岁(范围:2-23岁)。结果显示,Danyelza联合GM-CSF治疗的总缓解率(ORR)为34%、完全缓解率(CR)为26%、部分缓解率(PR)为8%。在有治疗反应的患者中,23%的患者缓解持续时间(DOR)≥6个月。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->