银屑病创新药!优时比IL-17A/17F双效抑制剂Bimzelx收获全球首份医疗评估:疗效优于多款生物药!
来源:本站原创 2021-09-07 03:32
Bimzelx强效中和IL-17A和IL-17,疗效击败修美乐(Humira)、喜达诺(Stelara)、可善挺(Cosentyx)。
重度斑块型银屑病(图片来源:iheartlung.com)
2021年09月06日讯 /生物谷BIOON/ --优时比(UCB)近日宣布,英国医疗技术评估机构——英国国家卫生与临床优化研究所(NICE)已发布其最终技术评估指南(TAG):推荐新型抗炎药Bimzelx(bimekizumab),作为一种治疗选择,用于对其他系统疗法无应答或对这些疗法存在禁忌症或不能耐受的重度斑块型银屑病成人患者。Bimzelx是一款IL-17A/IL-17F抑制剂,此次积极指导意见,代表着Bimzelx在全球范围内的首份医疗技术评估结果。
2021年8月,Bimzelx在英国和欧盟(EU)国家获得上市批准,用于治疗适合系统治疗的中度至重度斑块型银屑病成人患者。值得一提的是,Bimzelx是英国和欧盟(EU)国家批准的第一个旨在同时选择性抑制IL-17A和IL-17F的斑块型银屑病治疗药物。目前,欧盟(EU)国家正在对bimekizumab进行进一步的医疗技术评估,预计将在今年晚些时候做出决定。
Bimzelx是第一种通过NICE新的快速低风险快速评估(Expedited Low-Risk Fast Track appraisal)进行评估和推荐的药物。Bimzelx将在一个月内通过国家医疗服务系统(NHS)资助向英格兰和威尔士符合资格的患者提供治疗。Bimzelx将提供一个受欢迎的新治疗选择,帮助更多中重度斑块型银屑病患者实现治疗目标。用药方面,Bimzelx推荐剂量为320mg(皮下注射2针),每4周一次至第16周,此后每8周一次。对于一些体重≥120kg且在第16周未达到完全皮损清除的患者,第16周后给予每4周一次320mg可进一步改善治疗反应。
NICE根据一份提交的报告给出了推荐意见,该报告包含了bimekizumab银屑病3期临床项目的疗效和安全性数据。 NICE认为这些试验的证据表明bimekizumab比阿达木单抗(adalimumab,TNF抑制剂)、司库奇尤单抗(secukinumab,IL-17A抑制剂)、乌司奴单抗(ustekinumab,IL-12/IL-23抑制剂)更有效。NICE还得出结论,间接比较表明,bimekizumab与其他生物疗法(包括risankizumab[IL-23抑制剂]、brodalumab[IL-17A受体抑制剂] 、ixekizumab[IL-17A抑制剂])相比具有相似或更高的疗效。
优时比免疫解决方案执行副总裁兼美国负责人Emmanuel Caeymaex表示:“NICE的积极医疗技术评估确认了bimekizumab可以为患者、医疗系统和社会带来的价值,并以UCB承诺确保及时获得我们的创新药物为基础。我们很高兴bimekizumab能够快速应用于英格兰和威尔士的银屑病患者,并支持NICE对我们这一新的银屑病治疗方案的评估。”
bimekizumab作用机制(图片来源:mosmedpreparaty.ru)
银屑病会对患者的身体和心理产生相当大的影响,并损害患者的生活质量,可能影响工作、娱乐、人际关系,家庭和社会生活。一项横向患者调查显示,至少90%的中度至重度斑块状银屑病患者高度重视提供皮损清除、持续反应和快速起效的治疗。此外,一项现实世界研究表明,获得完全清洁的皮肤可以显著改善银屑病对患者健康相关生活质量的影响。
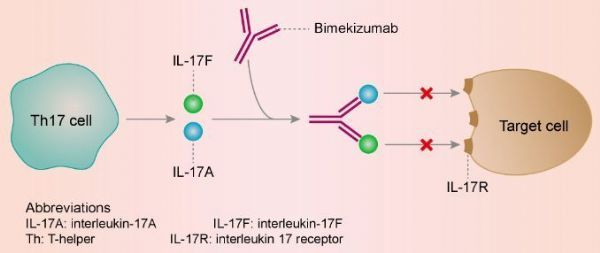
Bimzelx的活性药物成分bimekizumab是一种具有双重作用机制的独特分子,这是一种新型人源化单克隆IgG1抗体,能强效、选择性地中和IL-17A和IL-17F,这是驱动炎症过程的2种关键细胞因子。IL-17A和IL-17F具有相似的促炎功能,并独立地与其他炎症介质合作,在多个组织中驱动慢性炎症和损害。
bimekizumab独特的IL-17A/IL-17F双重抑制可能为治疗免疫介导的炎症性疾病提供一种新的靶向疗法。在疾病相关细胞中的临床前研究显示,在抑制IL-17A的同时抑制IL-17F能够减少皮肤和关节炎症以及病理性骨形成,其程度大于单独抑制IL-17A的程度。
在治疗中重度斑块型银屑病的3期临床研究中,Bimzelx疗效已被证实优于艾伯维Humira(修美乐,阿达木单抗,adalimumab,TNF抑制剂)、强生Stelara(喜达诺,乌司奴单抗,ustekinumab,IL-12/IL-23抑制剂)、诺华Cosentyx(可善挺,司库奇尤单抗,secukinumab,IL-17A抑制剂),显示出更高水平的皮损清除。在这些研究中,Bimzelx治疗的患者中约60%在第16周达到了皮损完全清除且反应持续一年,并且总体耐受性良好。

Bimzelx 3项3期临床研究数据汇总(图片来源:产品SmPC)
Bimzelx的监管批准,基于3项3期临床研究(BE VIVID、BE READY、BE SURE)的结果支持。这些研究评估了bimekizumab治疗中重度斑块型银屑病成人的疗效和安全性。所有研究均达到了共同主要终点和次要终点。与接受阿达木单抗(adalimumab)、安慰剂、乌司他单抗(ustekinumab)治疗的患者相比,接受bimekizumab治疗的患者在第16周实现了更优的皮损清除(PASI 90和IGA 0/1)。在所有研究中,bimekizumab在第16周达到的临床反应维持了一年,bimekizumab治疗患者中最常报告的治疗期不良事件为鼻咽炎、口腔念珠菌病和上呼吸道感染,
目前,bimekizumab治疗中重度斑块型银屑病成人患者的上市申请也正在接受美国FDA的审查。此外,bimekizumab在日本、澳大利亚、加拿大的监管审查也正在进行中。目前,优时比也正在3期临床试验中,评估bimekizumab治疗银屑病关节炎(PsA)、强直性脊柱炎(AS)、非放射学中轴型脊柱关节炎(nr-axSpA)、化脓性汗腺炎的疗效和安全性。
此前,医药市场调研机构Evaluate Vantage发布报告预测,bimekizumab上市后,2026年的全球销售额将达到26亿美元。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->