儿科抗生素!美国FDA批准艾伯维Dalvance(达巴万星):单剂量治疗急性细菌性皮肤及皮肤组织感染(ABSSSI)!
来源:本站原创 2021-07-24 03:30
Dalvance是第一用于从出生开始的儿科患者治疗ABSSSI的单剂量输液方案。
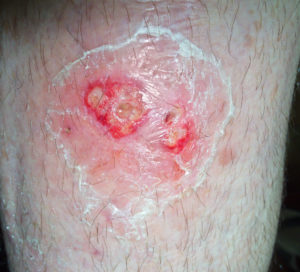
ABSSSI(图片来源:charlespollackmd.com)
2021年07月23日讯 /生物谷BIOON/ --艾伯维(AbbVie)近日宣布,美国食品和药物管理局(FDA)已批准Dalvance(dalbavancin,达巴万星),用于儿科患者(从出生到18岁以下)治疗急性细菌性皮肤及皮肤结构感染(ABSSSI)。
Dalvance是第一个也是唯一一个用于从出生开始的儿科患者治疗ABSSSI的单剂量输液方案。该药作为30分钟静脉(IV)输注给药,用于儿科患者治疗由指定的易感革兰氏阳性菌引起的ABSSSI,包括耐甲氧西林金黄色葡萄球菌(MRSA)引起的感染。用药方面,对于肌酐清除率≥30ml/min/1.73m2的儿科患者,批准的Dalvance推荐给药方案是:基于儿科患者年龄和体重的单剂量给药方案。
在美国,Dalvance之前已被批准用于成人(18岁及以上)治疗ABSSSI。在成人患者中,Dalvance是第一个也是唯一一个具有单剂量方案(1500mg)和双剂量方案(1000mg,一周后500mg)的静脉抗生素。
Dalvance是第二代、半合成、脂糖肽类抗生素,将一个亲脂性侧链加入到一种增强的糖肽主链。Dalvance在体外针对一系列革兰氏阳性菌具有杀菌活性,如金黄色葡萄球菌(包括耐甲氧西林,也称为MRSA菌株)和化脓性链球菌,以及某些其他链球菌属。
艾伯维传染病医疗主管Margaret Burroughs表示:“在儿童中的严重感染很难治疗,ABSSI对儿童的影响很大,因为这些感染通常需要静脉输注抗生素,导致住院治疗。批准Dalvance作为单剂量方案用于儿科患者,为治疗ABSSI儿童和婴儿提供了有意义的贡献。”
ABSSSI是皮肤和相关组织的细菌性感染,主要由革兰氏阳性病原体引起,包括金黄色葡萄球菌和化脓性链球菌。虽然ABSSSI很常见,但这些感染可以很严重,可能危及生命。ABSSSI是儿童发病率的一个重要来源。皮肤脓肿和蜂窝组织炎是儿科医生评估的主要皮肤感染类型。在美国,ABSSSI每年导致300万儿童保健就诊,给保健系统带来了沉重负担。

dalbavancin化学结构式(图片来源:selleck.cn)
此次批准基于一项多中心、开放标签、阳性对照临床试验(Dalvance治疗从出生到18岁以下的ABSSSI儿科患者)以及3项药代动力学研究的结果。在ABSSSI研究中,Dalvance与静脉注射万古霉素(对耐甲氧西林的革兰氏阳性感染)或静脉注射苯唑西林或氟氯西林(对甲氧西林敏感的革兰氏阳性感染)一起评估了安全性和有效性。研究中,患者以3:3:1的比例随机分配,接受单剂量Dalvance、双剂量Dalvance、或对照抗生素方案。研究的主要目的是评估Dalvance的安全性和耐受性。
为评估Dalvance在ABSSSI儿科试验中的治疗效果,对改良意向治疗(mITT)人群中183例ABSSSI患者进行了分析。mITT人群包括所有接受任何剂量研究药物且诊断为革兰氏阳性菌引起的ABSSI的随机化患者。
这项分析评估了在48-72小时的早期临床反应:基于病灶大小与基线检查相比减少≥20%且3岁及以上儿童没有接受抢救性抗菌治疗进行评估。从出生至3个月以下年龄组的5例患者未纳入疗效分析,因为这5例患者采用了扩大入组标准,只接受了单剂量Dalvance方案。
分析结果显示:出现早期临床反应的患者比例,在Dalvance单剂量组为97.3%(73/75),在Dalvance 2个剂量组为93.6%(73/78),在对照组为86.7%(26/30)。来自儿科患者的临床试验结果表明,Dalvance在儿科患者中的安全性结果与在成人患者中观察到的相似。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


