1型糖尿病疾病修正疗法!预防性免疫治疗单抗teplizumab遭美国FDA拒绝批准:但与疗效无关!
来源:本站原创 2021-07-07 03:34
teplizumab 2周疗程治疗将疾病风险↓50%、发病推迟≥2年,有潜力成为第一种可预防/延缓高危人群发展为临床1型糖尿病(T1D)的疗法。

2021年07月06日讯 /生物谷BIOON/ --Provention Bio公司近日宣布,美国食品和药物管理局(FDA)已针对teplizumab用于高危个体延缓临床1型糖尿病(T1D)的生物制品许可申请(BLA)发布了一封完整回应函(CRL)。
teplizumab是一种抗CD3单克隆抗体,用于高危人群预防或延缓发生临床1型糖尿病(T1D),这里的高危人群是指体内存在2种或多种与T1D相关的自身抗体。如果获得批准,teplizumab将成为第一种可预防/延缓高危人群发展为临床T1D的疗法,这将是继一个世纪前胰岛素问世以来,T1D治疗方面取得的第一个重大进展。
在美国,teplizumab于2019年8月被授予了突破性药物资格(BTD)。在欧盟,teplizumab之前还被授予了优先药物资格(PRIME)。PRIME是欧洲药品管理局(EMA)推出的一个快速审批项目,与美国FDA的BTD项目相似,旨在加速医药短缺领域重点药品的审评进程。
来自关键TN-10研究数据显示,在病程处于2期的1型糖尿病(T1D)症状前受试者中,与安慰剂相比,单个为期2周(14天)疗程的teplizumab治疗,将胰岛素依赖性临床期疾病延迟了至少2年。
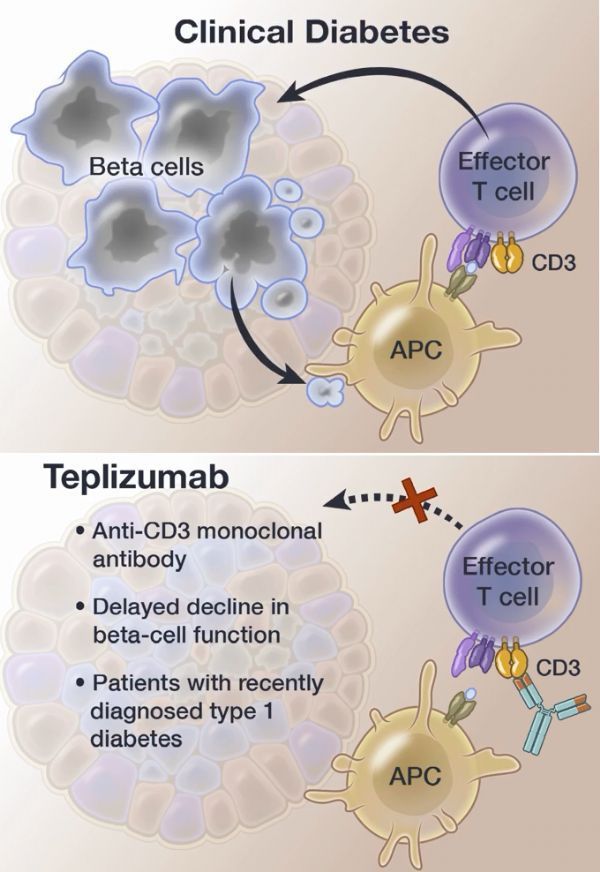
teplizumab作用机制
在CRL中,FDA指出,一项针对健康志愿者的单次、低剂量药代动力学/药效学(PK/PD)桥接研究未能显示PK可比性,该桥接研究旨在将计划的商业化产品与生产用于历史临床试验的原料药制备的药物产品进行比较。CRL中称“由于PK仍然是证明2种产品之间可比性的主要终点,您将需要在计划的商业化产品和临床试验产品之间适当地建立PK可比性,或者提供其他数据来充分证明为什么PK可比性不是必需的。”
Provention Bio公司预计,在本季度晚些时候对新诊断的T1D患者进行的3期PROTECT试验中,接受12天治疗的患者的PK/PD子研究正在收集或将收集相关的额外PK/PD数据。这些数据将由独立的、非盲的第三方进行分析,以保持安慰剂对照试验的完整性。在对该子研究的结果进行审查后,公司将决定是否将这些数据连同任何其他相关数据和基于公司与FDA正在进行的讨论的分析一起提交给FDA审查,以支持PK可比性或证明PK可比性不必要的其他理由。
在CRL中,FDA还列举了与产品质量有关的几个额外的考虑因素,Provention Bio公司认为这些因素要么已经在提交至BLA的修订中得到解决,要么可以在短期内得到解决。CRL承认,FDA没有审查该公司针对某些化学、制造和控制(CMC)信息请求已经提交的若干修订。FDA还表示,在最近对Provention Bio公司使用的灌装加工生产设施的一般检查中(非特定于teplizumab)发现了某些缺陷,这些缺陷需要在批准前得到解决。
CRL没有引用任何与提交至BLA的疗效和安全性数据包相关的临床缺陷,并确认了teplizumab拟议专有名称的可接受性。FDA要求该公司提供一个安全更新作为其BLA重新提交的一部分。CRL还包含了其他不影响可批准性的评论和建议,以及关于重新提交过程的一般指导。
Provention Bio联合创始人兼首席执行官Ashleigh Palmer表示:“我们非常感谢FDA审查小组在对BLA进行优先审查的整个过程中与我们进行了如此密切和透明的合作。目前,T1D社区正在迫切等待治疗进展。我们将继续与FDA合作,以期获得teplizumab的批准,并尽快为高危患者提供第一种针对T1D的疾病修正疗法。”
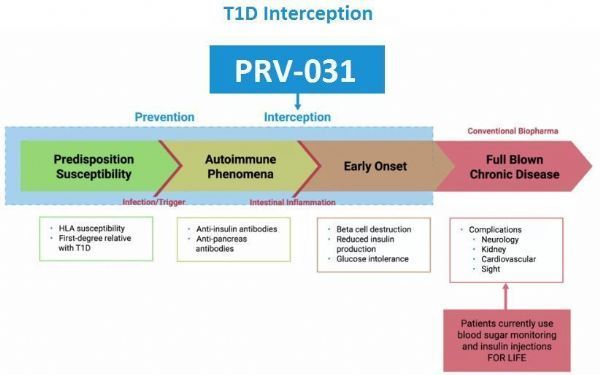
teplizumab(PRV-031)预防和干预1型糖尿病(T1D)病程
teplizumab是一种研究性抗CD3单克隆抗体,开发用于拦截和预防临床T1D。该抗体已在多项临床研究中进行了评估,涉及超过1000例患者,其中超过800例患者接受了teplizumab治疗。此前在新诊患者中开展的研究显示,teplizumab持续证明了其保持β细胞功能和减少外源性胰岛素使用的能力。
teplizumab的BLA,基于TrialNet开展的TN-10研究(“At-Risk”,NCT01030861)的临床数据。该研究评估了teplizumab用于高危群体预防或延缓发生临床1型糖尿病(T1D)的疗效和安全性。结果显示,与安慰剂相比,单个为期2周(14天)疗程的teplizumab治疗显著推迟了高危儿童和成人临床T1D的发病和诊断时间,T1D发病率降低50%,发病中位时间推迟至少2年。
这些数据清楚地显示,短期免疫治疗可以显著延缓T1D的临床发生,开发不需要连续治疗以影响自身免疫性疾病的免疫调节药物将是一个重大的模式转变。根据TN-10研究,teplizumab是第一个可显著延迟T1D临床发病的免疫调节剂,有望干预并从根本上改变高危群体的T1D进展!
除了评估teplizumab用于T1D患者亲属中具有高风险个体预防T1D的潜力之外,Provention Bio公司也正在评估teplizumab用于新诊断为胰岛素依赖性T1D患者的疗效(III期PROTECT研究)。
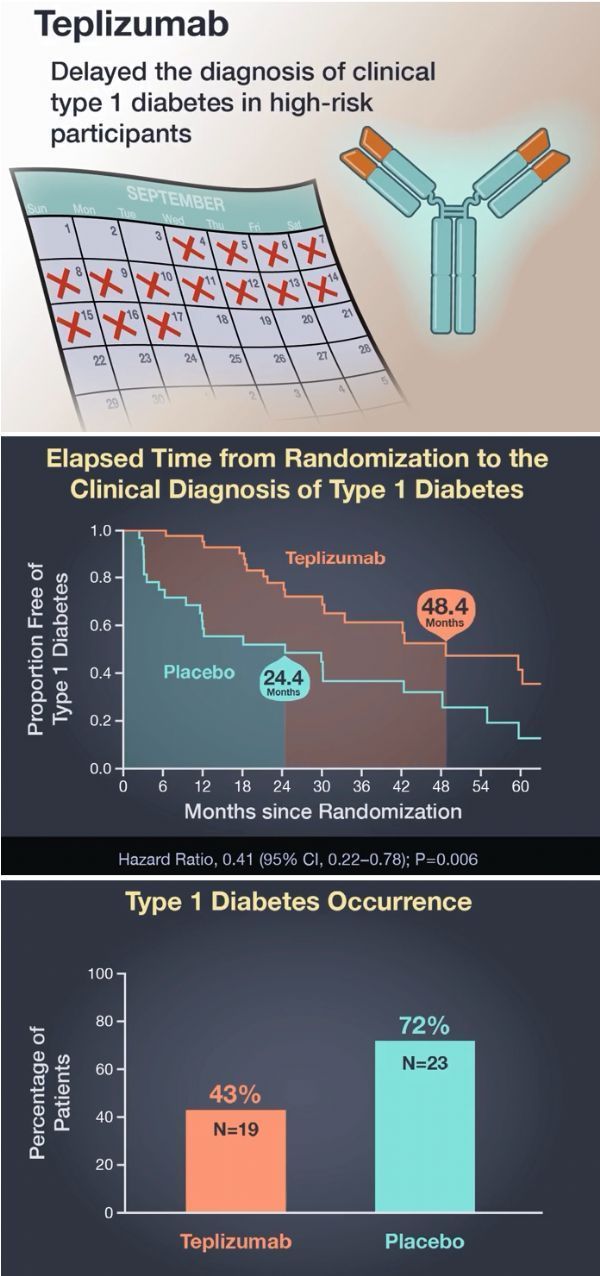
teplizumab临床试验数据
TN-10研究共入组了76例年龄8-49岁的“高危”受试者,这些受试者是1型糖尿病患者的亲属、存在2种或多种T1D自身抗体和异常的葡萄糖代谢(血糖异常)、没有糖尿病、但有很高的风险发展为糖尿病临床疾病。72%的受试者年龄在18岁以下。研究中,这些受试者随机接受teplizumab或安慰剂治疗。
研究结果已发表于国际医学期刊《新英格兰医学杂志》(NEJM),文章标题为:An Anti-CD3 Antibody, Teplizumab, in Relatives at Risk for Type 1 Diabetes。数据表明,在高危儿童和成人中,与安慰剂相比,单个14天疗程teplizumab治疗显著延迟了临床T1D的发病和诊断,延迟的中位时间为2年。具体为,安慰剂组受试者临床诊断T1D的中位时间为24.4个月,相比之下,teplizumab组受试者临床诊断T1D的中位时间为48.4个月(HR=0.41;95%CI:0.22-0.78;p=0.006)。在研究期间,安慰剂组有72%的患者出现临床糖尿病,teplizumab组仅为43%。研究中,teplizumab的耐受性良好,安全性数据与先前对新诊患者的研究一致。
这项具有里程碑意义的突破性研究表明,可以使用免疫疗法,特别是teplizumab,来预防或显著延缓临床1型糖尿病发作至少2年时间。更重要的是,研究中约60%的受试者在一个疗程的teplizumab治疗后没有出现T1D,比例是安慰剂组的2倍。
teplizumab是第一个显示可延迟T1D临床发病的免疫调节剂。其临床结果对于有患1型糖尿病风险的个人,如患者家属,具有真正的临床意义。延迟临床T1D的发病可能意味着疾病负担可能会推迟到患者能够更好地管理其疾病的时间,例如婴儿期、小学、高中甚至大学之后。teplizumab上市后,临床医生将可以干预并从根本上改变这些高危受试者的T1D进展。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


