1型神经纤维瘤病(NF1)药物!阿斯利康/默沙东新型口服激酶抑制剂Koselugo获欧盟附条件批准!
来源:本站原创 2021-06-23 03:28
Koselugo具有显著临床益处:客观缓解率(ORR)为66%,可持续缩小肿瘤体积、缓解疼痛、改善日常功能和生活质量。
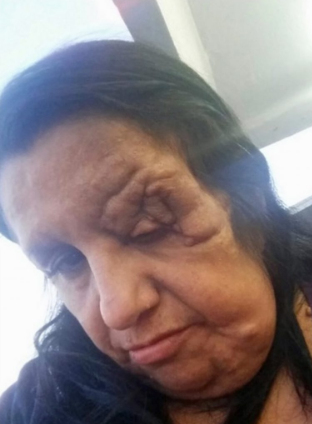
丛状神经纤维瘤(PN)(图片来源:storytrender.com)
2021年06月22日讯 /生物谷BIOON/ --阿斯利康(AstraZeneca)和默沙东(Merck & Co)近日联合宣布,其靶向抗癌药Koselugo(selumetinib)获欧盟委员会(EC)附条件批准,该药是一种新型口服激酶抑制剂,用于3岁及以上1型神经纤维瘤病(NF1)儿科患者,治疗症状性、不能手术切除的丛状神经纤维瘤(PN)。此次批准,使Koselugo成为了欧洲第一个治疗NF1的药物。在这项批准之前,手术是欧盟NF1儿童治疗PN的唯一治疗选择。这一批准标志着在解决这些肿瘤的致衰性影响方面向前迈出了重要一步。
NF1是一种使人衰弱的神经系统遗传性疾病,全球发病率为每3000人中就有一例。在30-50%的NF1患者中,肿瘤发生在神经鞘上(丛状神经纤维瘤[PN1]),可引起临床问题,例如:毁容、气道功能障碍、视力障碍、膀胱/肠道功能障碍。
2020年4月,Koselugo获得美国FDA批准,用于年龄≥2岁的NF1儿科患者,治疗NF1相关的症状性、不能手术的丛状神经纤维瘤(PN)。值得一提的是,Koselugo是美国FDA批准的第一种治疗NF1的药物。此前,Koselugo被授予了治疗NF1的孤儿药资格(ODD)和突破性药物资格(BTD)。Koselugo是一种激酶抑制剂,意味着它可通过关键酶发挥作用,从而阻止肿瘤细胞的生长。
此次批准,基于II期SPRINT Stratum 1试验的结果。这是一项由美国国家癌症研究所(NCI)癌症治疗评估项目(CTEP)赞助的试验,相关结果已发表于国际顶级医学期刊《新英格兰医学杂志》(NEJM),详见:Selumetinib in Children with Inoperable Plexiform。
SPRINT Stratum 1试验入组了50例儿科患者(中位年龄10.2岁,范围:3.5-17.4),这些儿童患有NF1和不能手术的PN(定义为不能完全切除但不会对患者造成严重发病风险的PN)。最常见的神经纤维瘤相关症状是毁容(44例)、运动功能障碍(33例)和疼痛(26例)。试验中,患者每天2次口服25 mg/m2(已批准的推荐剂量)的Koselugo,直到病情恶化或出现不可接受的不良反应。试验期间对患者肿瘤体积的变化和肿瘤相关疾病症状进行常规评估,并测定了总缓解率(ORR),定义为:3-6个月通过MRI证实有完全缓解或部分缓解(PN肿瘤体积减少≥20%)的患者比例。
数据显示,Koselugo(口服,每日2次)单药治疗对患者具有显著的临床益处:可持续缩小肿瘤体积、缓解疼痛、改善日常功能和总体健康相关生活质量。该试验中,Koselugo治疗的客观缓解率(ORR)为66%,50例患者中有33例确认部分应答。ORR是指经证实完全缓解(PN消失)或部分缓解(PR,肿瘤体积减少至少20%)的患者百分比。
对SPRINT Stratum 1试验进行更长时间随访而获得的疗效和安全性数据,是欧盟附条件批准Koselugo的条件之一。
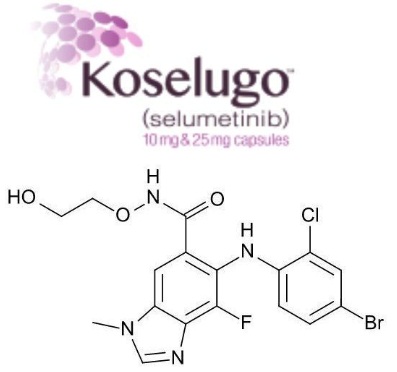
Koselugo活性药物成分selumetinib分子结构式(图片来源:lclabs.com)
NF1是一种致衰性、进行性、常常导致毁容的罕见疾病,这种疾病通常始于生命早期,由特定基因的突变或缺陷引起。NF1通常在儿童早期确诊,大约3000个婴儿中就有一个出现NF1,其特征是肤色(色素沉着)变化、神经和骨骼损伤、一生中发生良性和恶性肿瘤的风险。30%-50%的NF1患者出现一处或多处丛状神经纤维瘤(PN)。PN的主要治疗方法是手术切除。不幸的是,由于这些肿瘤的位置或体积,许多患者不适合进行手术。此外,NP通常在最佳手术切除后复发,因此代表了一个医疗需求未满足的重要领域。
Koselugo的活性药物成分为selumetinib,这是一种口服、强效、选择性MEK1/2激酶抑制剂。NF1基因编码神经纤维瘤蛋白(neurofibromin),该蛋白对RAS/MAPK通路进行负调控,帮助控制细胞生长、分化和存活。NF1基因突变可能导致RAS/RAF/MEK/ERK信号途径失调,而这可能导致细胞以不受控制的方式生长、分裂和复制,并可能导致肿瘤生长。selumetinib通过抑制这条途径中的MEK酶,潜在地抑制肿瘤生长。目前,selumetinib正在临床研究中评估作为单药疗法以及联合其他疗法治疗多种类型肿瘤的潜力。
selumetinib由Array BioPharma发现,阿斯利康于2003年授权获得了该化合物的全球独家权利。2018年7月,阿斯利康与默沙东达成肿瘤学战略合作,在全球范围内共同开发和商业化selumetinib和PARP抑制剂Lynparza。目前,双方正在开展I/II期临床研究SPRINT,在无法手术的NF1相关丛状神经纤维瘤(PN)儿科患者中探索selumetinib的潜在益处。Koselugo在成人NF1-PN患者中的临床试验,以及一种适合儿科患者的适龄制剂试验,计划在今年启动。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


