淋巴瘤新药!CD25抗体偶联药物camidanlumab tesirine(Cami)疗效强劲:总缓解率86%!
来源:本站原创 2021-05-31 19:31
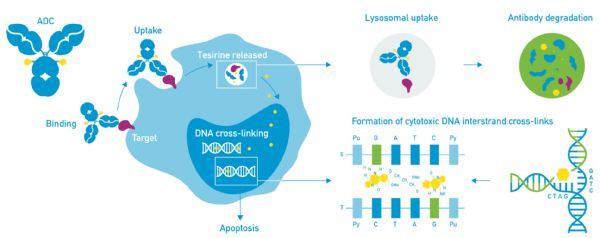
Cami可靶向攻击表达CD25的肿瘤细胞,在细胞内释放PBD毒素,导致细胞死亡。

2021年05月31日讯 /生物谷BIOON/ --ADC Therapeutics SA是一家瑞士生物技术公司,致力于开发和商业化治疗血液恶性肿瘤和实体瘤的高效靶向抗体偶联药物(ADC)。近日,该公司宣布,评估抗CD25 ADC疗法camidanlumab tesirine(Cami,前称ADCT-301)治疗复发或难治性霍奇金淋巴瘤(HL)和非霍奇金淋巴瘤(NHL)的1期临床研究(NCT02432235)结果已发表于国际医学期刊《柳叶刀-血液病学》(The Lancet Haematology),文章标题为:Camidanlumab tesirine in patients with relapsed or refractory lymphoma: a phase 1, open-label, multicentre, dose-escalation, dose-expansion study。
研究结果显示,Cami在治疗霍奇金淋巴瘤方面疗效显著:在接受2期临床试验推荐起始剂量(45μg/kg)Cami治疗的患者中,总缓解率(ORR)达到了86%,完全缓解率(CR)为49%。该研究中,Cami显示出可接受的安全性。
Cami是一种靶向CD25的抗体偶联药物(ADC),由一种靶向结合CD25的单克隆抗体(HuMax®-TAC,由Genmab A/S授权)通过连接器与吡咯并苯并二氮杂卓(pyrrolobenzodiazepine,PBD)二聚体细胞毒素tesirine偶联而成。一旦与表达CD25的细胞结合,Cami就会被内化到细胞中,在那里酶解释放PBD二聚体细胞毒素tesirine,该毒素能不可逆地与DNA结合,从而产生阻止DNA链分离的强力链间交联,从而破坏复制等必要的DNA代谢过程,最终导致细胞死亡。
Cami可靶向攻击表达CD25的肿瘤细胞,也可攻击表达CD25的调节性T细胞(Treg)。向肿瘤内释放PBD毒素也可能引起邻近肿瘤细胞的旁观者杀伤效应,PBD也被证明可诱导免疫原性细胞死亡。Cami的这些特性可能增强免疫介导的抗肿瘤活性。
临床开发方面,Cami正在一项关键2期临床试验中评估治疗复发性或难治性霍奇金淋巴瘤患者、在一项1b期临床试验中评估作为单药疗法以及与默沙东抗PD-1疗法Keytruda(可瑞达,帕博利珠单抗)联合用药治疗多种实体瘤。
PBD二聚体ADC技术(点击图片,查看大图)
目前,ADC Therapeutics公司正在推进其专有的基于PBD的ADC技术,改变血液系统恶性肿瘤和实体瘤患者的治疗模式。
2021年4月,基于PBD ADC技术开发的首个产品Zynlonta(loncastuximab tesirine)获得了美国FDA批准,用于治疗已接受过2种或多种系统疗法的复发或难治性(r/r)大B细胞淋巴瘤(LBCL)成人患者,包括弥漫性大B细胞淋巴瘤(DLBCL)、起源于低级别淋巴瘤和高级别细胞淋巴瘤的DLBCL。
Zynlonta是获得监管批准的第一个靶向CD19的ADC疗法,通过优先审查程序获得加速批准。在中国,Zynlonta正由ADC Therapeutics与瓴路药业(Overland Pharmaceuticals)成立的合资公司Overland ADCT BioPharma开发。根据中国国家药品监督管理局(NMPA)药品审评中心(CDE)检索结果,Zynlonta已获得一项临床试验模式许可(受理号:JXSL2000231)。
Zynlonta的活性药物成分为loncastuximab tesirine,由一种人源化抗人CD19单克隆抗体通过连接器与PBD二聚体细胞毒素tesirine偶联而成。一旦与表达CD19的细胞结合,loncastuximab tesirine就会被细胞内化,随后释放出细胞毒素,该毒素能不可逆地与DNA结合,从而产生阻止DNA链分离的强力链间交联,从而破坏复制等必要的DNA代谢过程,最终导致细胞死亡。CD19是一个经验证的治疗B细胞恶性肿瘤的热门靶点。

loncastuximab tesirine分子结构
此次发表于《柳叶刀-血液病学》的是一项多中心、开放标签、单臂、剂量递增和剂量扩展1期临床试验的结果。该试验入组了133例成人患者,其中77例(58%)为典型霍奇金淋巴瘤(cHL),56例(42%)为NHL。入组的患者经病理证实为复发性或难治性cHL或NHL,并且没有针对其疾病阶段具有确定临床益处的治疗方法可用。研究中,Cami(3至150μg/kg)通过静脉数组给药,每3周一次。主要目的是评估剂量限制毒性、确定最大耐受剂量和推荐扩展剂量,并评估Cami的安全性。
结果显示,中位随访9.2个月,在所有缓解可评估患者中,总缓解率(ORR)为58%,130例患者中有38例(29%)报告完全缓解。
在先前接受过多种疗法的HL患者中,在所有剂量下,ORR为71%、77例患者中有32例(42%)报告完全缓解。在接受45μg/kg剂量(推荐的2期起始剂量)的HL患者中,ORR为86%、37例患者中有18例(49%)报告完全缓解。在接受30μg/kg剂量的HL患者中,ORR为55%,20例患者中有7例(35%)报告完全缓解。在NHL患者中,ORR为38%,53例患者中有5例(9%)报告完全缓解。所有HL患者中中位缓解持续时间(DOR)为6.6个月、接受45μg/kg剂量的HL患者中为7.2个月。
该研究中,Cami显示出可接受的安全性。最常见的不良反应包括肝酶升高(无肝合成功能障碍)、皮疹、疲劳、水肿或渗出以及恶心。
根据1期临床试验的数据,进一步评估Cami治疗复发性或难治性HL安全性和有效性的2期试验正在进行中。在2020年美国血液学会会议上发表的关键2期试验的中期数据显示,Cami作为单一药物,抗肿瘤活性令人鼓舞,ORR为83%,完全缓解率为38%,没有新的安全信号。这些数据强调了Cami在先前接受过多种疗法(中位数:7种)的患者中未满足医疗需求的潜力。(生物谷Bioon.com)
原文出处:ADC Therapeutics Announces Online Publication of Camidanlumab Tesirine Phase 1 Results in The Lancet Haematology
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->