CAR-T细胞疗法研究进展(第19期)
来源:本站原创 2021-01-31 22:52
2021年1月31日讯/生物谷BIOON/---CAR-T(Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。该疗法是一种出现了很多年但近几年才被改良使用到临床中的新型细胞疗法。在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被 认为是最有前景的肿瘤治疗方式之一。正如所有的技术一
2021年1月31日讯/生物谷BIOON/---CAR-T(Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。该疗法是一种出现了很多年但近几年才被改良使用到临床中的新型细胞疗法。在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被 认为是最有前景的肿瘤治疗方式之一。正如所有的技术一样,CAR-T技术也经历一个漫长的演化过程,正是在这一系列的演化过程中,CAR-T技术逐渐走向成熟。
这种新的治疗策略的关键之处在于识别靶细胞的被称作嵌合抗原受体(chimeric antigen receptor, CAR)的人工受体,而且在经过基因修饰后,病人T细胞能够表达这种CAR。在人体临床试验中,科学家们通过一种类似透析的过程提取出病人体内的一些T细胞,然后在实 验室对它们进行基因修饰,将编码这种CAR的基因导入,这样这些T细胞就能够表达这种新的受体。这些经过基因修饰的T细胞在实验室进行增殖,随后将它们灌注回病人体内。这些T细胞利用它们表达的CAR受体结合到靶细胞表面上的分子,而这种结合触发一种内部信号产 生,接着这种内部信号如此强效地激活这些T细胞以至于它们快速地摧毁靶细胞。
近年来,CAR-T免疫疗法除了被用来治疗急性白血病和非霍奇金淋巴瘤之外,经改进后,也被用来治疗实体瘤、自身免疫疾病、HIV感染和心脏病等疾病,具有更广阔的应用空间。基于此,针对CAR-T 细胞疗法取得的最新进展,小编进行一番盘点,以飨读者。
1.Nat Commun:靶向GD2和B7H3的synNotch CAR-T细胞有望治疗神经母细胞瘤
doi:10.1038/s41467-020-20785-x
嵌合抗原受体(CAR)T细胞(CAR-T)疗法彻底改变了对白血病的治疗。遗憾的是,该疗法对治疗包括诸如神经母细胞瘤之类的儿童癌症在内的实体瘤并不有效。使用某些CAR-T细胞对神经母细胞瘤进行的临床前研究揭示了毒性作用。
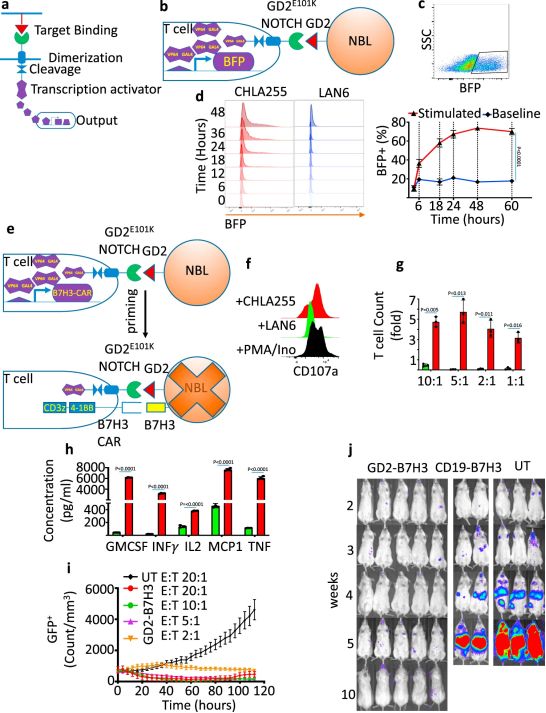
构建高度特异性、高效的GD2-B7H3 T细胞,图片来自Nature Communications, 2021, doi:10.1038/s41467-020-20785-x。
如今,在一项新的研究中,来自美国洛杉矶儿童医院的研究人员开发出一种改良版的CAR-T细胞,它在靶向神经母细胞瘤方面显示出了希望:更有效地杀死了癌细胞,同时又不会伤害健康的脑组织。虽然这项研究还处于临床前阶段,但是它揭示了对患有实体瘤的儿童和成人进行拯救生命的治疗的潜力。相关研究结果于2021年1月21日发表在Nature Communications期刊上,论文标题为“Preclinical assessment of the efficacy and specificity of GD2-B7H3 SynNotch CAR-T in metastatic neuroblastoma”。
2.Hepatology:新研究表明IDRA HBV-TCR-T细胞攻击肝细胞癌,同时暂时免受免疫抑制药物的影响
doi:10.1002/hep.31662
在一项新的研究中,来自杜克-新加坡国立大学医学院的研究人员和新加坡其他研究机构的研究人员设计了一种经过武装的免疫细胞,它们可以攻击肝移植患者中的复发癌症,同时暂时逃避患者为避免器官排斥而服用的免疫抑制剂。相关研究结果近期发表在Hepatology期刊上,论文标题为“Immunosuppressive Drug Resistant Armored TCR T cells for immune‐therapy of HCC in liver transplant patients”。
论文共同通讯作者、杜克-新加坡国立大学医学院的Antonio Bertoletti教授说,“我们开发了一种方法来制造特异性地靶向肝癌细胞中HBV抗原的T细胞,同时让它们对两种常用的免疫抑制剂---他克莫司(tacrolimus )和吗替麦考酚酯(mycophenolate mofetil)---产生抗性。”
Bertoletti教授补充道,“重要的是,我们的T细胞对免疫抑制剂的抵抗性只持续了大约四天,之后它们就会恢复对这些药物的敏感性。”
3.Nature子刊论文详解!靶向CXCR5的CAR-T细胞有望治疗滤泡性淋巴瘤和慢性淋巴细胞白血病
doi:10.1038/s41467-020-20488-3
在一项新的研究中,来自德国马克斯-德尔布鲁克分子医学中心的研究人员开发出一种新的CAR-T细胞疗法。他们发现这种方法非常有效,特别是在对抗滤泡性淋巴瘤和慢性淋巴细胞白血病(CLL)时。相关研究结果于2021年1月11日发表在Nature Communications期刊上,论文标题为“CXCR5 CAR-T cells simultaneously target B cell non-Hodgkin’s lymphoma and tumor-supportive follicular T helper cells”。
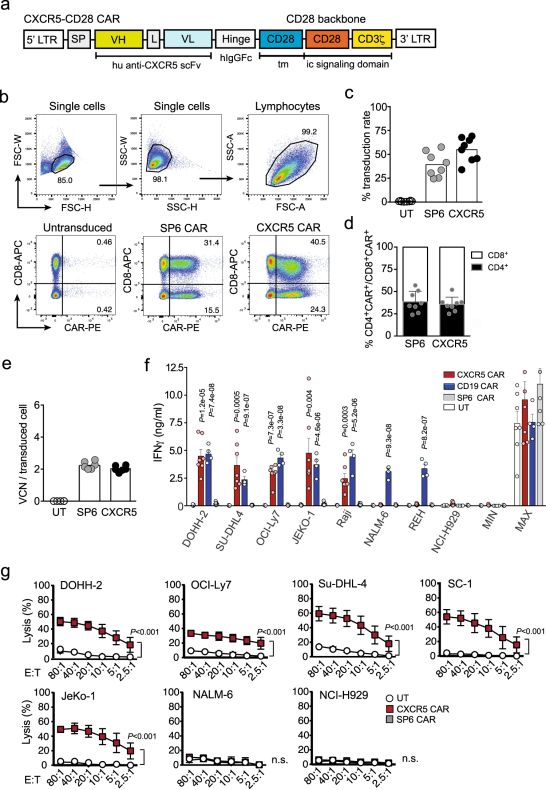
图片来自Nature Communications, 2021, doi:10.1038/s41467-020-20488-3。
身体的防御系统通常不会将癌细胞识别为危险的细胞。为了校正这种有时是致命的错误,这些研究人员正在研究一种聪明的新想法,这种想法涉及从癌症患者身上提取少量免疫细胞,并在实验室中对它们进行“改造”,使得它们能够识别恶性肿瘤细胞的某些表面蛋白。然后,他们对这些免疫细胞进行增殖,并将它们注入回相同患者的血液中---让它们开始在体内穿行,以有针对性的方式检测和攻击所有癌细胞。
4.重磅!科学家们识别出新型靶点 有望帮助开发治疗胰腺癌的安全有效的CAR-T细胞疗法!
doi:10.1158/1078-0432.CCR-19-2163
近日,一篇发表在国际杂志Clinical Cancer Research上题为“CEACAM7 Is an Effective Target for CAR T-cell Therapy of Pancreatic Ductal Adenocarcinoma”的研究报告中,来自伦敦大学等机构的科学家们通过研究发现了一种特殊蛋白,其或能作为开发胰腺癌新型疗法的潜在治疗性靶点,利用这种蛋白作为靶点,研究人员就能成功开发出一种CAR-T细胞疗法(一类免疫疗法)来在临床前模型中杀灭胰腺癌细胞。
通过利用一种名为免疫染色(immunostaining)的特殊技术,研究人员分析了人类PDAC样本和正常组织中CEACAM7的存在,他们发现,所检测的PDAC样本中有很大一部分样本都能够表达CEACAM7分子,但该蛋白却在一些正常组织中并不存在,包括扁桃体、肺部组织、肝脏和前列腺等,这就表明,CEACAM7或许能作为一种理想的靶点帮助开发治疗胰腺癌的CAR-T细胞疗法。为了确定CEACAM7作为疗法靶点的潜力,研究人员开发了一种能针对CEACAM7分子的CAR-T细胞,并将其应用于PDAC细胞系和PDAC临床前模型中,CAR-T细胞能有效靶向作用PDAC培养的细胞中表达CEACAM7分子的细胞,并能够在晚期PDAC临床前模型中消除癌细胞。
5.Sci Trans Med:新型开关可调节CAR-T细胞活性
doi:10.1126/scitranslmed.abb6295
CAR T细胞是一种有效的基于细胞的免疫疗法,已在治疗某些晚期癌症方面取得了巨大成功,但其构成有明显毒副作用的风险。对此,Dana-Farber癌症研究所和麻省癌症总医院的科学家创造了分子“ON-OFF”开关来调节CAR T细胞的活性。
CAR-T细胞是经过免疫修饰的免疫细胞,可以识别和攻击肿瘤细胞。一旦给药,这些“活体药物”会在数周至数月内增殖并杀死肿瘤细胞。然而,在某些情况下会引起难以控制的威胁生命的炎症反应。
科学家在《Science Translational Medicine》杂志中报道了可切换的CAR T细胞的开发过程,可通过给予常用的抗癌药物来那度胺来开启或关闭。在实验室中,研究人员通过施用这种药物可以迅速,可逆地关闭它,然后CAR T细胞恢复其抗肿瘤活性。将来,可切换细胞疗法可能会允许患者调整每天的CAR T细胞活性,从而有望减少毒性副作用。
6.JEM:新型组合性策略或有望增强乳腺癌免疫疗法的作用效力!
doi:10.1084/jem.20200844
近日,一项刊登在国际杂志Journal of Experimental Medicine上的研究报告中,来自北卡罗来纳大学等机构的科学家们通过对小鼠进行研究发现,激活最著名的能对抗病毒和细菌感染的免疫信号通路或能增强遗传工程化T细胞清除乳腺癌的能力。研究者指出,能用来治疗人类特定类型癌症的CAR-T细胞如果与其它免疫疗法相结合的话,也能够有效成功治疗实体瘤。
这项研究中,研究者Serody及其同事在乳腺癌小鼠模型中检测了多种策略来增强CAR-T细胞的效力,其中一种有效策略就是利用诸如cGAMP等药物来治疗小鼠能够激活其机体中的STING通路,该通路是一种在正常情况下能诱导机体炎症以对入侵的病毒或细菌产生反应的免疫细胞信号通路。激活STING通路就能够在小鼠机体肿瘤中产生一种促炎性环境,并能够改善CAR-T细胞积累并攻击肿瘤细胞的能力,与使用标准技术所产生的CAR-T细胞相比,当给小鼠机体中输注能产生免疫信号分子IL-17A的CAR-T细胞时,小鼠机体的积累情况就会增加。
研究者表示,我们通过研究确定,如果利用治疗性抗体来治疗小鼠的话,其机体中的CAR-T细胞的攻击就能持续更长时间,这种治疗性抗体能从肿瘤环境中清除免疫抑制细胞,并防止免疫检查点使得CAR-T细胞失活。研究者发现,当将所有的方法进行结合时就能完全剔除小鼠机体乳腺中的肿瘤。
7.CRISPR-Cas9技术编辑的CAR-T细胞或能增强机体抵御血液癌症的潜力
新闻来源:CRISPR-edited CAR T cells enhance fight against blood cancers
近日,在2020年第62届美国血液学会年会(ASH)上,来自宾夕法尼亚大学的科学家们展示了他们最新的临床前研究结果,他们发现,利用CRISPR/Cas9技术敲除CAR-T细胞上能抑制T细胞激活的特殊蛋白或能增强工程化T细胞清除血液癌症的能力。研究人员敲除了CAR-T细胞上名为CD5的基因,随后将其输注回携带T细胞和B细胞白血病/淋巴瘤的小鼠体内,CD5基因能编码T细胞表面的CD5蛋白,而且还会抑制其激活。相比输注了非编辑CAR-T细胞的小鼠而言,输注了CD5被剔除的CAR-T细胞的小鼠机体外周血中的T细胞增殖水平较高,而且肿瘤尺寸发生了明显下降,且小鼠有更好的生存结局。
CRISPR技术能帮助科学家们锁定并编辑任何不需要的基因,以癌症为例,该技术就能通过剔除T细胞中的特殊基因来帮其更好地抵御肿瘤,这种方法与CAR-T细胞疗法密切相关,即研究人员通过收集患者机体自身的T细胞,对其进行工程化修饰表达新型受体从而寻找并攻击癌细胞。医学博士Marco Ruella说道,我们通过研究首次表明,我们可以成功利用CRISPR/Cas9技术来敲除CAR-T细胞表面的CD5,从而增强其攻击癌症的能力,在多种癌症模型中,编辑和非编辑CAR-T细胞之间的差异非常惊人。
研究人员首次在T细胞白血病模型中检测了这种新方法,抗CD5的CAR-T细胞能被遗传工程化修饰来寻找恶性T细胞上的CD5并对其发起攻击;由于CD5在正常T细胞中也会表达,随后研究人员从CAR-T细胞对CD5进行了移除,这样就能避免对其它CAR-T细胞的杀灭效应,从而就能潜在释放CAR-T细胞的激活,否则就会被这些细胞上CD5的存在所抑制。
8.Cell论文解读!新发现颠覆对杀伤性T细胞的传统认知,有助开发出更好靶向实体瘤的CAR-T细胞
doi:10.1016/j.cell.2020.11.019
一类称为“杀伤性T细胞”的免疫细胞,也被称为细胞毒性或溶细胞性CD8 T细胞。在一项新的研究中,来自美国宾夕法尼亚大学佩雷尔曼医学院的研究人员发现杀伤性T细胞通常会留在血液中,不会进入器官和其他组织。相关研究结果于2020年12月10日在线发表在Cell期刊上,论文标题为“The Identity of Human Tissue-Emigrant CD8+ T Cells”。

图片来自Cell, 2020, doi:10.1016/j.cell.2020.11.019。
这一发现可能有助于解决免疫学中的许多难题,包括具有医学意义的谜团,比如,为何最近开发的使用经过基因改造的杀伤性T细胞的癌症疗法不能很好地对抗实体瘤,以及为何被认为对杀伤性T细胞非常脆弱的艾滋病致病病毒HIV似乎能够通过躲在血液之外来无限期地逃避这些免疫细胞。
9.ASH2020:临床试验表明CAR-T细胞疗法可高度有效治疗晚期非霍奇金淋巴瘤
新闻来源:CAR T-cell therapy found highly effective in patients with high-risk non-Hodgkin lymphoma
美国达纳-法伯癌症研究所的研究人员在虚拟的第62届美国血液学会(ASH)年会上报告说,在一项2期临床试验中,一种称为axicabtagene ciloleucel(axi-cel)的CAR-T细胞疗法将近80%的晚期非霍奇金淋巴瘤(NHL)患者体内的癌细胞降低到无法检测的水平。 虽然NHL往往是一种生长缓慢的疾病,但是患者在标准治疗后经常复发,这突显了对新疗法的需求。这些研究人员表示,axi-cel在已复发或对其他药物产生耐药性的临床试验参与者中的有效性特别令人鼓舞。
达纳-法伯癌症研究所的Caron Jacobson博士领导了这项临床试验。他说,“我们对治疗反应的幅度和持久性印象深刻。这种治疗方法对这些疾病的高危患者产生了有意义的影响。我也很早就意识到,与我们在快速增长的淋巴瘤中所看到的相比,它的安全性有多好。”
10.PNAS:工程化T细胞可用于治疗自体免疫疾病
doi:10.1073/pnas.2012495117
一项新的研究发现,由亚利桑那大学健康科学研究人员基因工程改造的新型T细胞能够靶向并攻击导致1型糖尿病的病原性T细胞,这可能会导致新的免疫疗法。
免疫系统通过利用几种类型的T细胞来对抗细菌,病毒和其他病原体,所有这些T细胞都具有对特定抗原具有特异性的受体。在杀伤性T细胞上,该受体与三个信号传导模块和一个共受体协同工作,以破坏受感染的细胞。UArizona医学院免疫生物学系副教授Michael Kuhns博士以工程化的方式合成了五模块嵌合抗原受体或5MCAR T细胞。
“我们设计了一种5MCAR,它将引导杀伤性T细胞靶向引发型糖尿病的自身免疫。”Kuhns博士说,他是UArizona癌症中心,BIO5研究所和亚利桑那州衰老中心的成员。 “因此,杀伤性T细胞实际上将识别另一个T细胞。”
Kuhns博士与哈佛医学院糖尿病中心的Thomas Serwold博士合作,在非肥胖糖尿病小鼠模型中测试了5MCAR T细胞,并取得了可喜的结果。这些发现最近发表在《PNAS》杂志上。
11.Nat Cancer:将CAR-T细胞疗法与特殊抑制剂药物相结合或有望治疗多种类型癌症!
doi:10.1038/s43018-020-00147-8
肿瘤微环境中错综复杂的血管“迷宫”依然是细胞疗法渗透并治疗实体瘤最困难的障碍之一,近日,一项刊登在国际杂志Nature Cancer上的研究报告中,来自宾夕法尼亚大学佩雷尔曼医学院等机构的科学家们通过研究发现,将CAR-T细胞疗法与PAK4抑制剂药物相结合或能促进工程化细胞突破并攻击肿瘤,从而就能显著提高小鼠的存活率。
研究人员在实验室中发现,实体瘤的血管化是由PAK酶所引起的肿瘤内皮细胞的基因重编程来驱动的,在胶质母细胞瘤小鼠模型中,敲除该酶类或能降低肿瘤异常的血管分布,并改善T细胞的浸润和CAR-T细胞的免疫疗法治疗效果,胶质母细胞瘤是一种最常见的恶性脑瘤,每年美国有超过2.2万人发病。
研究者Yi Fan说道,胶质母细胞瘤患者通常对CAR-T细胞疗法反应较差,因为CAR-T细胞很难进入到肿瘤内部,本文研究结果表明,利用PAK4抑制剂关闭肿瘤内皮细胞的基因重编程或许就有望让T细胞和工程化的T细胞到达肿瘤内部发挥杀灭癌细胞的作用。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


