EGFR-MET双特异性抗体!强生amivantamab治疗EGFR外显子20插入突变肺癌(NSCLC):总缓解率40%!
来源:本站原创 2021-01-29 17:33
amivantamab将第一款治疗EGFR外显子20插入突变肺癌的靶向疗法。

2021年01月29日/生物谷BIOON/--强生(JNJ)旗下杨森制药近日在由国际肺癌研究协会主办的2020年第21届世界肺癌大会(WCLC)线上会议上公布了EGFR-MET双特异性抗体amivantamab治疗肺癌I期CHRYSALIS研究(NCT02609776)的新数据。该研究在在接受含铂化疗期间或之后病情进展、携带EGFR外显子20插入突变的转移性或不可切除性非小细胞肺癌(NSCLC)患者中开展。目前,这类患者尚无批准的靶向疗法。
结果显示,amivantamab具有强大的临床抗肿瘤活性和持久应答:总缓解率(ORR)为40%、中位缓解持续时间(DOR)为11个月、中位无进展生存期(PFS)为8.3个月、中位总生存期(OS)为22.8个月、临床受益率(病情≥部分缓解或病情稳定≥11周)为74%。这些数据已提交给美国FDA和欧盟EMA,代表着朝着解决这一患者群体中高度未满足需求迈出的重要一步。
会议报告者、纽约大学朗格尼珀尔马特癌症中心(NYU Langone’s Perlmutter cancer Center)医学博士Joshua K.Sabari表示:“对于携带EGFR外显子20插入突变的非小细胞肺癌患者,其疾病通常对化疗和用于治疗其他表皮生长因子受体(EGFR)突变的酪氨酸激酶抑制剂应答不佳,因此非常需要新的治疗方案。今天介绍的CHRYSALIS研究结果表明,amivantamab有潜力解决这一关键的未满足需求,并为患者提供重要的临床益处。”
在全球范围内,肺癌是最常见的癌症类型,非小细胞肺癌(NSCLC)占所有肺癌的80-85%。NSCLC的主要亚型为腺癌、鳞状细胞癌、大细胞癌。NSCLC最常见的驱动突变是EGFR基因中的改变,EGFR是一种受体酪氨酸激酶,帮助细胞生长和分裂。EGFR突变存在于10%-15%的NSCLC患者中、40%-50%的亚洲NSCLC腺癌患者中。EGFR第20号外显子插入突变是肺腺癌的一个独特亚群,占所有EGFR突变的至少9%。目前,转移性NSCLC患者的5年生存率仅为6%。
EGFR第20号外显子有插入突变的NSCLC患者,通常对已批准上市的GFR受体酪氨酸激酶抑制剂(TKI)治疗不敏感,与更常见的EGFR突变(19号外显子缺失/L858R替代)的患者相比,预后更差。目前,针对EGFR第20号外显子有插入突变的肺癌患者,估计的中位总生存期(OS)为16个月,临床上的标准护理方案是是常规细胞毒性化疗,尚无批准的靶向疗法。
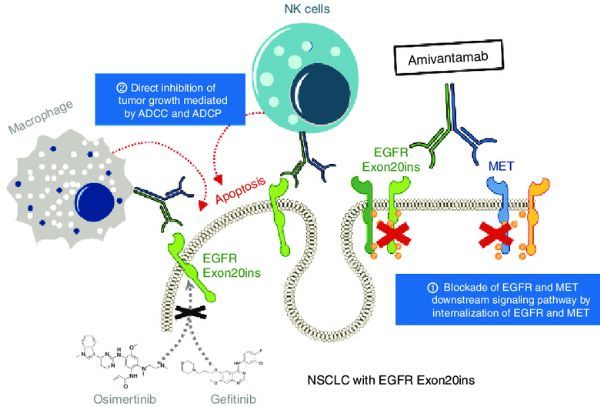
amivantamab是一种在研的全人EGFR-间质表皮转化因子(MET)双特异性抗体,具有免疫细胞导向活性,靶向携带激活和耐药EGFR及MET突变及扩增的肿瘤。amivantamab的生产和开发遵循了杨森生物科技公司与Genmab签订的使用DuoBody技术平台的许可协议。
基于CHRYSALIS研究的总缓解率和缓解持久数据,2020年12月,杨森制药向美国FDA和欧盟EMA提交了amivantamab的上市申请文件,用于治疗接受含铂化疗病情进展、表皮生长因子受体(EGFR)基因第20号外显子有插入突变的转移性非小细胞肺癌(NSCLC)患者。2020年3月,美国FDA授予了amivantamab突破性药物资格(BTD)。
值得一提的是,这标志着欧盟和美国针对携带EGFR外显子20插入突变的NSCLC患者治疗提交的首份监管申请文件。如果获得批准,amivantamab将成为第一款专门靶向EGFR外显子20插入突变NSCLC的疗法。
amivantamab作用机制(图片来源文献——doi-10.1158/2159-8290.CD-20-0116)
CHRYSALIS一项首次人体、开放标签、多中心I期研究,正在评估amivantamab作为单药疗法、以及与新型第三代EGFR-TKI药物lazertinib联合用药治疗晚期NSCLC成人患者的安全性、药代动力学和疗效。
此次会上公布的分析中,研究人员评估了amivantamab在先前接受铂类化疗病情进展、携带EGFR外显子20插入突变的NSCLC患者(铂后队列)中的疗效和安全性。研究中,该队列患者接受了amivantamab推荐的II期剂量(RP2D:1050mg,体重≥80kg的患者为1400mg)治疗。研究主要终点是总缓解率(ORR),采用实体瘤疗效评价标准1.1版(RECIST v1.1)进行评估疾病缓解。其他终点包括缓解持续时间(DOR)、临床受益率、无进展生存期(PFS)和总生存期(OS)。
结果显示,在铂后疗效队列(n=81)中,通过盲法独立中心审查(BICR)评估的ORR为40%(n=32,95%CI:29-51),其中3例(4%)实现完全缓解(CR)、29例(36%)实现部分缓解(PR)。在病情实现缓解的患者中,缓解表现持久,中位DOR为11.1个月(95%CI:6.9-未达到[NE])。其中20例患者(63%)缓解持续≥6个月。中位PFS为8.3个月(95%CI:6.5–10.9)、中位OS为22.8个月(95%CI:14.6-未达到[NE])。临床受益率(≥PR或病情稳定≥11周)为74%(95%CI:63-83)。
在接受RP2D剂量amivantamab治疗的患者(n=114)中,最常见的治疗期间出现的不良事件(TEAE)是皮疹(86%)、输液相关反应(IRR,66%)、甲沟炎(45%)。其他不良事件为口腔炎(21%)和瘙痒(17%)。35%的患者报告≥3级不良事件,其中16%被认为与治疗相关,最常见的是皮疹(4%)和IRR(3%)。未报告与治疗相关的死亡。导致剂量减少和停药的治疗相关不良事件分别为13%和4%。(生物谷Bioon.com)
原文出处:New Amivantamab Data from CHRYSALIS Study Show Robust Clinical Activity and Durable Responses in Patients with Metastatic or Unresectable Non-Small Cell Lung Cancer and EGFR Exon 20 Insertion Mutations
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->