结节性痒疹新药!美国FDA授予OSMRβ靶向阻断单抗vixarelimab突破性药物资格!
来源:本站原创 2020-11-18 16:56
在2a期临床试验中,与安慰剂相比,vixarelimab治疗显著降低了瘙痒严重程度。

2020年11月18日讯 /生物谷BIOON/ --Kiniksa Pharma是一家临床阶段的生物制药公司,其管线资产旨在调节免疫通路治疗多种疾病。近日,该公司宣布,美国食品和药物管理局(FDA)已授予vixarelimab治疗结节性痒疹(prurigo nodularis,PN)相关瘙痒的突破性药物资格(BTD)。结节性痒疹是一种以严重瘙痒性皮肤结节为特征的慢性炎症性皮肤病。vixarelimab是一种靶向抑瘤素M受体β(OSMRβ)的全人单克隆抗体。
BTD是FDA在2012年创建的一个新药评审通道,旨在加快开发及审查用于治疗严重或威及生命的疾病、并且有初步临床证据表明该药与现有治疗药物相比在一个或多个具有临床意义的终点方面有显著改善的新药。获得BTD的药物,在研发时能得到包括FDA高层官员在内的更加密切的指导,保障在最短时间内为患者提供新的治疗选择。
Kiniksa首席执行官兼董事会主席Sanj K.Patel表示:“FDA授予vixarelimab治疗结节性痒疹相关瘙痒的突破性药物资格是一个大好消息。vixarelimab治疗结节性痒疹的2a期研究表明,在瘙痒和结节反应方面都取得了令人鼓舞的结果。我们相信vixarelimab有潜力对结节性痒疹患者的生活产生积极影响,这是一种毁灭性的疾病,目前尚无FDA批准的治疗方法。”
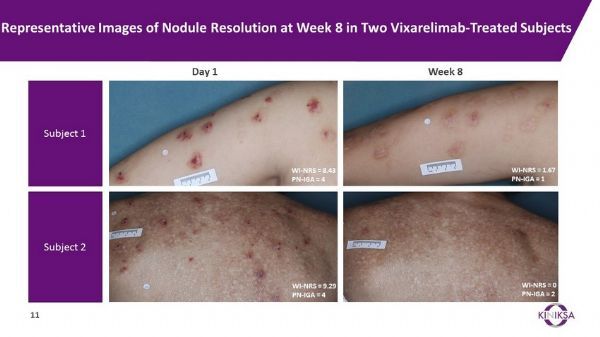
FDA授予vixarelimab BTD,是基于vixarelimab治疗结节性痒疹2a期临床试验的数据。该试验达到了主要疗效终点:在治疗第8周,与安慰剂组相比,vixarelimab组患者每周平均最严重瘙痒数值评分量表(WI-NRS)较基线水平显著降低。此外,在第8周,与安慰剂组相比,vixarelimab组大多数患者表现出每周平均WI-NRS有≥4分的临床意义的降低、有统计学显著更高比例的患者达到结节性痒疹整体评估(PN-IGA)得分为0/1。该研究结果详见:Kiniksa Announces Phase 2 Clinical Trial of Vixarelimab (KPL-716) in Prurigo Nodularis Meets Primary Efficacy Endpoint。
vixarelimab治疗效果
PN是一种伴多发结节性皮损的慢性瘙痒性皮肤病,这是一种罕见的、潜在致衰性的慢性皮肤病,厚的皮肤结节覆盖大面积身体并与严重瘙痒相关。该病经常导致严重的生活质量损害。
vixarelimab是一种靶向OSMRβ的全人单克隆抗体。OSMRβ介导白细胞介素-31(IL-31)和抑瘤素M(OSM)的信号传导,这2种细胞因子与瘙痒、炎症和纤维化有关。据Kiniksa公司认为,vixarelimab目前开发的唯一一款同时靶向这2种通路的单克隆抗体。目前,vixarelimab开发的主要适应症是结节性痒疹。Kiniksa公司计划在今年底前启动vixarelimab治疗结节性痒疹的2b期临床试验,评估每月一次的给药方案。
值得一提的是,在2019年11月,美国FDA还授予了nemolizumab治疗结节性痒疹的突破性药物资格(BTD)。nemolizumab由全球最大的独立皮肤学公司Galderma开发,该药是一种首创的(first-in-class)单克隆抗体,可靶向结合白细胞介素31受体A(IL-31RA),被认为通过竞争性地阻断IL-31与其受体的结合来抑制IL-31的生物活性,阻断IL-31信号传导。IL-31是一种诱导瘙痒的细胞因子,其信号传导在PN发病机制中起着关键作用。
nemolizumab由中外制药研制。2016年,Galderma公司从中外制药授权获得了nemolizumab的全球(日本和中国台湾除外)权利。nemolizumab采用中外制药专有的抗体工程化技术ACT-Ig创造,该技术能够延长抗体在血液中的生物学半衰期。
今年2月,评估nemolizumab治疗中重度结节性痒疹(PN)成人患者II期研究(NCT03181503)的完整结果发表于《新英格兰医学杂志》(NEJM)。文章标题:Trial of Nemolizumab in Moderate-to-Severe Prurigo Nodularis。
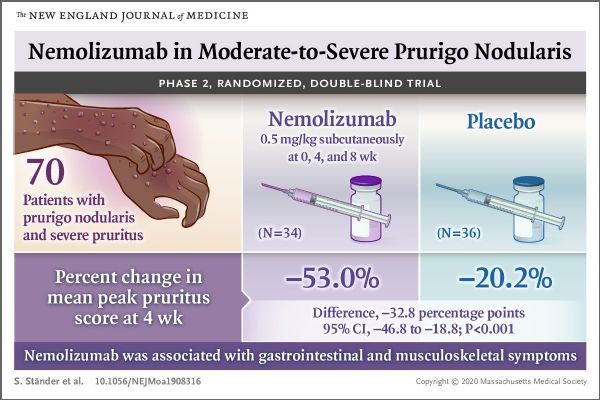
NEJM上发表的这项研究,是一项随机、双盲、安慰剂对照、平行组、多中心、12周II期研究,共入组了70例伴有中度至重度PN和重度瘙痒的成人患者。研究中,从基线至第8周,患者被随机分配接受每4周一次皮下注射nemolizumab(剂量:0.5mg/kg体重)或安慰剂,第0周(基线)、第4周、第8周分别皮下注射一次。该研究中,中度至重度结节性痒疹定义为有20个或20个以上结节,重度瘙痒定义为数值评分量表上最严重瘙痒日强度的平均评分至少为7分(评分范围为0[无瘙痒]至10[可想象的最严重瘙痒])。
结果显示,研究达到了主要终点:从基线至第4周,与安慰剂组相比,nemolizumab治疗组峰值瘙痒数值评定量表(PP-NRS)评分相对基线显著降低。2个组基线PP-NRS评分为8.4分。在第4周,nemolizumab治疗组PP-NRS评分相比基线降低4.5分(变化:-53.0%),安慰剂组降低1.7分(变化:-20.2%),数据具有统计学显著差异(差异:-32.8%;95%CI:-46.8至-18.8,p<0.001)。此外,在所有其他指标方面,nemolizumab治疗组均显示出显著差异。在第18周(最后一次给药后10周),nemolizumab治疗组有38%的患者完全清除或几乎完全清除PN,安慰剂组为6%(p=0.001)。研究中,nemolizumab耐受性良好,两组之间未观察到不良事件的不平衡。nemolizumab治疗与胃肠道症状(腹痛和腹泻)和肌肉骨骼症状相关。(生物谷Bioon.com)
原文出处:Kiniksa Announces Breakthrough Therapy Designation Granted to Vixarelimab for the Treatment of Pruritus Associated with Prurigo Nodularis
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->